题目内容
17.5%的氢氧化钠溶液与10克稀盐酸反应,边加边搅拌,溶液pH的变化如图所示,请据图回答:
(1)在进行该反应时,B溶液是稀盐酸;
(2)b点溶液中的溶质是NaCl和NaOH(写化学式),此时滴入酚酞试液,溶液呈红色;
(3)当恰好完全反应时,消耗氢氧化钠溶液的质量为16克;
(4)计算稀盐酸中溶质的质量分数.
分析 根据给出的pH变化图可知,加入的是氢氧化钠溶液,烧杯中原有溶液为稀盐酸;a点为恰好完全反应,b点为氢氧化钠过量,由图可以看出加入16g氢氧化钠溶液时恰好完全反应.
解答 解:
(1)在进行该反应时,根据图可以看出逐渐增加的量也就是横坐标为氢氧化钠的质量,所以B溶液是 稀盐酸(根据其实pH小于7也可以确认烧杯中的液体为稀盐酸);
(2)是氢氧化钠溶液不断加入到稀盐酸中去,到达a点时,pH等于7,表示恰好完全反应,此时消耗的氢氧化钠溶液的质量为16g.之后继续加入氢氧化钠溶液,此时是氢氧化钠过量,所以b点溶液中的溶质是 NaCl和 NaOH(写化学式),由于此时溶液为氢氧化钠溶液过量,所以此时滴入酚酞试液,溶液呈红色;
(3)根据(2)分析可知,恰好完全反应时消耗的氢氧化钠溶液的质量为16g.
(4)设稀盐酸中溶质的质量为x
NaOH+HCl=NaCl+H2O
40 36.5
16g×5% x
$\frac{40}{36.5}$=$\frac{16g×5%}{x}$
x=0.73g
稀盐酸中溶质的质量分数为$\frac{0.73g}{10g}$×100%=7.3%.
故答案为:(1)稀盐酸;
(2)NaCl和 NaOH; 红色;
(3)16;
(4)7.3%.
点评 本题最重要的是从图中获取信息用于计算.根据化学方程式计算时,第一要正确书写化学方程式,第二要使用正确的数据,第三计算过程要完整.

练习册系列答案
 捷径训练检测卷系列答案
捷径训练检测卷系列答案 小夫子全能检测系列答案
小夫子全能检测系列答案
相关题目
5.在化学实验或日常生活中都应强化安全意识.下列做法符合安全要求的是( )
| A. | 一氧化碳还原氧化铁实验中,将尾气直接排放 | |
| B. | 加热液体时,试管底部接触酒精灯灯芯 | |
| C. | 点燃可燃性气体之前,先检验气体的纯度 | |
| D. | 稀硫酸不小心滴到手上,无需处理 |
12. MgSO4、KCl广泛用于工业领域,参考如图判断下列说法正确的是( )
MgSO4、KCl广泛用于工业领域,参考如图判断下列说法正确的是( )
 MgSO4、KCl广泛用于工业领域,参考如图判断下列说法正确的是( )
MgSO4、KCl广泛用于工业领域,参考如图判断下列说法正确的是( )| A. | t2℃时MgSO4的饱和溶液降温才有溶质析出 | |
| B. | t3℃时的KCl溶液降温至0℃一定有溶质析出 | |
| C. | t1℃两物质的饱和溶液升温到t2℃,溶质质量分数相等 | |
| D. | t1℃MgSO4的饱和溶液恒温蒸发溶剂不一定有溶质析出 |
9.下列对事实的解释中,不合理的是( )
| A. | 生铁和钢的性能不同--组成中含碳量不同 | |
| B. | 金刚石和石墨物理性质差异较大--碳原子的结构不同 | |
| C. | 硫在空气和氧气中燃烧的火焰颜色不同--氧气浓度不同 | |
| D. | 氢氧化钠和氢氧化钙化学性质相似--溶液中都含有大量的OH- |
6.硝酸铵的化学式为NH4NO3,下列说法正确的是( )
| A. | 硝酸铵属于氧化物 | |
| B. | 硝酸铵中氮元素与氧元素的质量比是2:3 | |
| C. | 硝酸铵中氢元素的质量分数最大 | |
| D. | 硝酸铵不能与碱性物质混合存放 |
7.规范的实验操作是实验成功的关键.下列实验操作正确的是( )
| A. |  剩余药品放回原瓶 | B. |  稀释浓硫酸 | ||
| C. |  铁丝在氧气中燃烧 | D. |  称量固体氢氧化钠 |
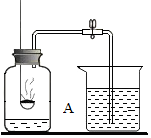 用如图所示的装置测定空气里氧气的含量,实验时先在集气瓶里加入少量水,做上记号.用弹簧夹夹紧乳胶管.点燃燃烧匙内的红磷后,立即深入瓶中并把塞子塞紧,待红磷熄灭后,发现红磷还有剩余,冷却,打开弹簧夹,烧杯中的水倒流进集气瓶中,液面上升到图中A位置.
用如图所示的装置测定空气里氧气的含量,实验时先在集气瓶里加入少量水,做上记号.用弹簧夹夹紧乳胶管.点燃燃烧匙内的红磷后,立即深入瓶中并把塞子塞紧,待红磷熄灭后,发现红磷还有剩余,冷却,打开弹簧夹,烧杯中的水倒流进集气瓶中,液面上升到图中A位置. 实验室常用如图装置图可做一氧化碳还原氧化铁的实验,并检验反应生成的气体产物.请写出硬质玻璃管和试管中发生反应的化学方程式.该实验有不足之处,应如何改进?
实验室常用如图装置图可做一氧化碳还原氧化铁的实验,并检验反应生成的气体产物.请写出硬质玻璃管和试管中发生反应的化学方程式.该实验有不足之处,应如何改进?