题目内容
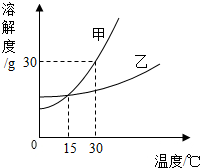
根据如图甲、乙两种固体物质的溶解度曲线,回答下列问题:(1)在 ℃时,甲、乙两种物质的溶解度相等;
(2)在20℃时,甲的溶解度 乙的溶解度(填“>”、“=”或“<”);
(3)40℃时,将50g甲物质放入100g水中,充分溶解,形成的是 (填“饱和”或“不饱和”)溶液,溶质的质量分数为 ;(计算结果精确到0.1%)
(4)将甲、乙两种物质的饱和溶液由50℃降到20℃时,甲溶液溶质质量分数比乙溶液溶质质量分数 (填“大”或“小”).

【答案】分析:根据固体物质的溶解度曲线可以:①查出某物质在一定温度时的溶解度,根据溶解度可以进行有关的分析、计算;②比较不同物质在同一温度下的溶解度的大小,③两条溶解度曲线的交点表示该点所示的温度下,两物质的溶解度是相同的;④判断出物质的溶解度随温度变化的变化情况,从而可以确定将饱和溶液降温时是否有晶体析出,从而进行有关的分析判定.
解答:解:(1)由甲、乙两种固体物质的溶解度曲线可知,在30℃时,甲、乙两种物质的溶解度相等;
(2)由甲、乙两种固体物质的溶解度曲线可知,在20℃时,甲的溶解度<乙的溶解度;
(3)由甲物质的溶解度曲线可知,在40℃时,甲的溶解度是70g,由溶解度的涵义可知,40℃时,将50g甲物质放入100g水中,充分溶解,形成的是不饱和溶液,溶质的质量分数为: ×100%=33.3%;
×100%=33.3%;
(4)由甲、乙两种固体物质的溶解度曲线可知,甲的溶解度都随温度的升高而增大,乙的溶解度都随温度的升高增大幅度不大,当将甲、乙两种物质的饱和溶液由50℃降到20℃时,都有晶体析出,都形成了20℃时的饱和溶液,由于在20℃时,甲的溶解度<乙的溶解度,所以,在20℃时的饱和溶液中,甲溶液溶质质量分数比乙溶液溶质质量分数小.
故答为:(1)30;(2)<;(3)不饱和,33.3%;(4)小.
点评:主要考查了固体溶解度曲线的意义及温度对固体溶解度的影响,培养学生分析问题、解决问题的能力.
解答:解:(1)由甲、乙两种固体物质的溶解度曲线可知,在30℃时,甲、乙两种物质的溶解度相等;
(2)由甲、乙两种固体物质的溶解度曲线可知,在20℃时,甲的溶解度<乙的溶解度;
(3)由甲物质的溶解度曲线可知,在40℃时,甲的溶解度是70g,由溶解度的涵义可知,40℃时,将50g甲物质放入100g水中,充分溶解,形成的是不饱和溶液,溶质的质量分数为:
 ×100%=33.3%;
×100%=33.3%;(4)由甲、乙两种固体物质的溶解度曲线可知,甲的溶解度都随温度的升高而增大,乙的溶解度都随温度的升高增大幅度不大,当将甲、乙两种物质的饱和溶液由50℃降到20℃时,都有晶体析出,都形成了20℃时的饱和溶液,由于在20℃时,甲的溶解度<乙的溶解度,所以,在20℃时的饱和溶液中,甲溶液溶质质量分数比乙溶液溶质质量分数小.
故答为:(1)30;(2)<;(3)不饱和,33.3%;(4)小.
点评:主要考查了固体溶解度曲线的意义及温度对固体溶解度的影响,培养学生分析问题、解决问题的能力.

练习册系列答案
相关题目
 以下是同学们在学习溶液知识时实验报告中的部分内容,分析后请回答:
以下是同学们在学习溶液知识时实验报告中的部分内容,分析后请回答:
| 试管编号 | 加入液体 | 加入物质 | 现象 |
| 1 | 10mL水 | 少量食盐 | 不溶 |
| 2 | 10mL乙醇 | 少量食盐 | 溶解 |
| 3 | 10mL水 | 几小粒碘 | 不溶 |
| 4 | 10mL乙醇 | 几小粒碘 | 溶解 |
(2)除(1)中的因素外,你认为固体物质的溶解能力还与外界条件______有关.
如果外界条件和溶剂的种类确定,要比较硝酸钾和氯化钠的溶解能力,实验中需要控制的因素是______.
(3)根据如图甲、乙两种固体物质的溶解度曲线,你能获得的信息是______、______(答两条).
 (2006?淄博)以下是同学们在学习溶液知识时实验报告中的部分内容,分析后请回答:
(2006?淄博)以下是同学们在学习溶液知识时实验报告中的部分内容,分析后请回答: 根据如图甲、乙两种固体物质的溶解度曲线,回答下列问题:
根据如图甲、乙两种固体物质的溶解度曲线,回答下列问题: 根据如图甲、乙两种固体物质的溶解度曲线,回答下列问题:
根据如图甲、乙两种固体物质的溶解度曲线,回答下列问题: