题目内容
碳在氧气中全部燃烧后,同时生成CO和CO2气体共10 g,将混合气通入过量的澄清石灰水(CO不与石灰水反应),生成沉淀10 g,求参加反应的碳的质量。
答案:
解析:
提示:
解析:
| 设混合气体中CO2的质量为x。
CO2+Ca(OH)2====CaCO3↓+H2O 44 100 x 10 g 44∶100=x∶10
g 混合气体中CO的质量为:10 g-4.4 g=5.6 g。 设生成4.4 g CO2需要碳的质量为y1,生成5.6 g CO需要碳的质量为y2。 C+O2 12 44 y1 4.4 g 12∶44=y1∶4.4 g ∴y1=1.2 g 2C+O2 24 46 y2 5.6 g 24∶56=y2∶5.6 g ∴y2=2.4 g 所以参加反应的碳的质量为:y1+y2=1.2
g+2.4 g=3.6 g 答:参加反应的碳的质量为3.6 g。
|
提示:
| 根据题目可知,碳与氧气的反应有两种情况:①碳与充足氧气反应生成二氧化碳②碳与不充足氧气反应生成一氧化碳;在两个反应中都要消耗碳,故参加反应的碳的质量是两个反应中消耗碳的质量之和。本题的计算切入点为用10 g CaCO3沉淀求CO2的质量,再以CO2的质量求CO和C的质量。
|

练习册系列答案
相关题目
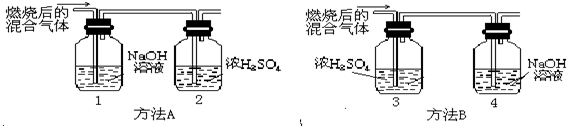
 某有机物在氧气中充分燃烧,产物只有二氧化碳和水.甲、乙两组同学分别用A、B两种方法测定它们的组成,得到两组数据(如图所示).
某有机物在氧气中充分燃烧,产物只有二氧化碳和水.甲、乙两组同学分别用A、B两种方法测定它们的组成,得到两组数据(如图所示).