题目内容
 某有机物在氧气中充分燃烧,产物只有二氧化碳和水.甲、乙两组同学分别用A、B两种方法测定它们的组成,得到两组数据(如图所示).
某有机物在氧气中充分燃烧,产物只有二氧化碳和水.甲、乙两组同学分别用A、B两种方法测定它们的组成,得到两组数据(如图所示).
| 燃烧有机物的质量 | 实验方法 | 实验前后(1) | (4)装置的质量 | ||
| 实验前 | 实验后 | ||||
| 甲组 | 3.2g | B | (3)150g | (3)154.6g | |
| (4)150g | (4)153.4g | ||||
| 乙组 | 3.2g | A | (1)150g | (1)153.6g | |
| (2)150g | (2)154.4g | ||||
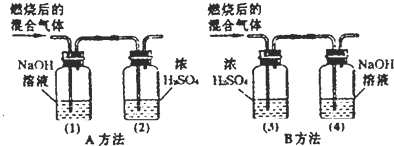
(1)要得出正确得结论,选用的方法应该是(填A或B)
A
A
.(2)用正确方法推测出该有机物是由
碳、氢、氧
碳、氢、氧
元素组成,各元素的质量比为1:3:4
1:3:4
.(实验过程中气体均全部被吸收)分析:(1)根据实验装置的作用分析解答:通过浓硫酸质量的增加测定生成水的质量,依据氢氧化钠质量的增加测定生成二氧化碳的量,气体从溶液中出来要带部分水蒸气,故要排除水蒸气的干扰,须先通过浓硫酸,再通过氢氧化钠溶液;
(2)据浓硫酸质量的增加量是生成水的质量,计算出水中氢元素的质量,根据氢氧化钠的质量的增加量就是生成二氧化碳的质量,计算出碳元素的质量,把碳元素的质量加上氢元素的质量,再与有机物质量比较,看是否含有氧元素,并计算物质中各元素的质量比.
(2)据浓硫酸质量的增加量是生成水的质量,计算出水中氢元素的质量,根据氢氧化钠的质量的增加量就是生成二氧化碳的质量,计算出碳元素的质量,把碳元素的质量加上氢元素的质量,再与有机物质量比较,看是否含有氧元素,并计算物质中各元素的质量比.
解答:解:(1)通过浓硫酸质量的增加测定生成水的质量,依据氢氧化钠质量的增加测定生成二氧化碳的量,气体从溶液中出来要带部分水蒸气,故要排除水蒸气的干扰,须先通过浓硫酸,再通过氢氧化钠溶液,选择A方法;
(2)据质量守恒定律可知反应前后元素种类不变,有机物燃烧生成二氧化碳和水,可知有机物中含有碳元素和氢元素,也就是说生成的水中的氢元素就是有机物中的氢元素,生成的二氧化碳中碳元素的质量就是有机物中碳元素的质量,浓硫酸质量的增加量是生成水的质量,氢氧化钠的质量的增加量就是生成二氧化碳的质量;在检验二氧化碳质量和水的质量时,根据A方法计算:浓硫酸质量增加了3.6g,所以生成水3.6g,则氢元素的质量:3.6g×
×100%≈0.4g,氢氧化钠溶液质量增加了4.4g,所以生成二氧化碳质量为4.4g,所以碳元素质量为:4.4g×
×100%≈1.2g,所以碳元素和氢元素质量和为:0.4g+1.2g=1.6g,因为有机物质量为3.2g,所以有机物中还含有氧元素3.2g-1.6g=1.6g,故碳、氢、氧元素的质量比是:0.4g:1.2g:1.6g=1:3:4;
故答案为:
(1)A;(2)碳、氢、氧;1:3:4.
(2)据质量守恒定律可知反应前后元素种类不变,有机物燃烧生成二氧化碳和水,可知有机物中含有碳元素和氢元素,也就是说生成的水中的氢元素就是有机物中的氢元素,生成的二氧化碳中碳元素的质量就是有机物中碳元素的质量,浓硫酸质量的增加量是生成水的质量,氢氧化钠的质量的增加量就是生成二氧化碳的质量;在检验二氧化碳质量和水的质量时,根据A方法计算:浓硫酸质量增加了3.6g,所以生成水3.6g,则氢元素的质量:3.6g×
| 1×2 |
| 1×2+16 |
| 12 |
| 12+16×2 |
故答案为:
(1)A;(2)碳、氢、氧;1:3:4.
点评:解答本题的关键是明确浓硫酸质量的增加量就是生成水的质量,氢氧化钠溶液质量的增加量就是生成的二氧化碳的质量,要测定水的质量须先通过浓硫酸,并能据质量守恒定律进行相关的分析和计算.

练习册系列答案
相关题目
某有机物在氧气中充分燃烧后,产生只有二氧化碳和水,甲、乙两组同学分别用下图两种方法测定它的组成.请你分析,并参与测定工作;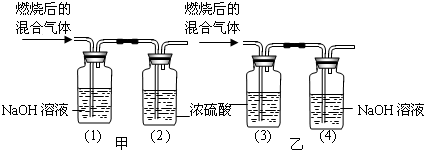
(1)你选用的实验装置是 (“甲”或“乙”),你不选另一个装置的原因是 .
(2)根据表中数据,推测出该有机物是由 元素组成的,各元素的质量比为 (假设实验过程中气体均全部被吸收).
提示:浓硫酸可以吸收水蒸气,氢氧化钠可以吸收二氧化碳.

| 燃烧有机物的质量 | 实验装置 | 实验(1)~(4)装置质量 | ||
| 实验前 | 实验后 | |||
| 甲组 | 1.6g | 甲 | (1)150g | (1)154.6g |
| (2)150g | (1)153.4g | |||
| 乙组 | 1.6g | 乙 | (3)150g | (1)153.6g |
| (4)150g | (1)154.4g | |||
(2)根据表中数据,推测出该有机物是由
提示:浓硫酸可以吸收水蒸气,氢氧化钠可以吸收二氧化碳.
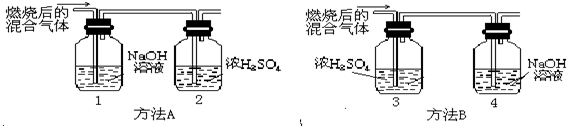
 (2005?青浦区)某有机物在氧气中充分燃烧后,产物只有二氧化碳和水.甲、乙两组同学分别用A、两种方法(为如图所示)测定它的组成,得到两组数据(见下表).请你分析:浓H2SO4具有
(2005?青浦区)某有机物在氧气中充分燃烧后,产物只有二氧化碳和水.甲、乙两组同学分别用A、两种方法(为如图所示)测定它的组成,得到两组数据(见下表).请你分析:浓H2SO4具有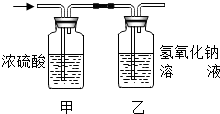 (2012?牡丹江)某有机物在氧气中充分燃烧,将生成的水蒸气、二氧化碳气体依次通过装置甲和乙 (假设每步吸收完全),称量通入气体前后装置的质量,数据如下:
(2012?牡丹江)某有机物在氧气中充分燃烧,将生成的水蒸气、二氧化碳气体依次通过装置甲和乙 (假设每步吸收完全),称量通入气体前后装置的质量,数据如下: