题目内容
16.为了测定氢氧化钙与碳酸钙的混合物中钙元素的质量,现将42克含氢氧化钙与碳酸钙的混合物跟260克稀盐酸恰好完全反应,产生2.2气体:计算:(1)混合物中钙元素的质量;
(2)反应后所得溶液中溶质的质量分数(精确到0.1%).
分析 根据碳酸钙能与稀盐酸反应生成氯化钙、水和二氧化碳,氢氧化钙能与稀盐酸反应生成氯化钙和水,该固体混合物与100g某盐酸恰好完全反应,生成二氧化碳4.4g,由二氧化碳气体的质量可计算出参加反应的碳酸钙的质量、生成氯化钙的质量,进而可计算出溶液中溶质的质量分数.
解答 解:设参加反应的碳酸钙的质量为x,
CaCO3+2HCl═CaCl2+H2O+CO2↑
100 44
x 2.2g
$\frac{100}{x}$=$\frac{44}{2.2g}$
x=5g
则原固体混合物中含氢氧化钙42g-5g=37g
混合物中钙元素的质量为:5g×$\frac{40}{100}$×100%+37g×$\frac{40}{74}$×100%=22g;
依据钙元素守恒可知,设生成氯化钙的质量为y
Ca---------CaCl2,
40 111
22g y
$\frac{40}{22g}$=$\frac{111}{y}$
y=61.05g
反应后所得溶液中溶质的质量分数是:$\frac{61.05g}{42g+260g-2.2g}$×100%≈20.4%.
故答案为:(1)22g;
(2)20.4%.
点评 本题难度不大,掌握利用化学方程式与溶质质量分数的综合计算即可正确解答本题,解题时要注意解题的规范性.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
9.除去下列物质中的少量杂质,所选试剂及操作都正确的是( )
| 物质 | 杂质 | 试剂 | 操作 | |
| A | Fe | Fe2O3 | 盐酸 | 结晶 |
| B | NH4HCO3 | NaCl | - | 加热 |
| C | Cu(NO3)2溶液 | BaCl2 | AgNO3溶液 | 过滤 |
| D | O2 | 水蒸气 | 浓硫酸 | 洗气 |
| A. | A | B. | B | C. | C | D. | D |
1.下列变化中,一定发生化学变化的是( )
| A. | 玻璃破碎 | B. | 干冰升华 | C. | 氢气燃烧 | D. | 浓硫酸吸水 |
4.下列物质既是空气的成分,又属于氧化物的是( )
| A. | 二氧化碳 | B. | 氧气 | C. | 氧化铝 | D. | 稀有气体 |
 如图是初中化学常见的物质间的转化关系,其中X为硫酸,A、B、G、H都含有同一种元素,Y、F、H均为单质,其中Y、H是常见的金属,H为红色固体.部分反应物和生成物及反应条件均已略去.试推断:
如图是初中化学常见的物质间的转化关系,其中X为硫酸,A、B、G、H都含有同一种元素,Y、F、H均为单质,其中Y、H是常见的金属,H为红色固体.部分反应物和生成物及反应条件均已略去.试推断: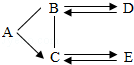 已知A、B、C、D、E是初中化学常见的不同类别的五种物质,D是一种红色固体,B→D的反应过程较为复杂,D→B的反应用于冶金工业,中“-”表示相连物质可以发生反应,“→”表示一种物质生成另一种物质(部分反应物、生成物及反应条件省略).
已知A、B、C、D、E是初中化学常见的不同类别的五种物质,D是一种红色固体,B→D的反应过程较为复杂,D→B的反应用于冶金工业,中“-”表示相连物质可以发生反应,“→”表示一种物质生成另一种物质(部分反应物、生成物及反应条件省略).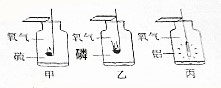 如图是三种物质在氧气中燃烧的实验.
如图是三种物质在氧气中燃烧的实验.