题目内容
14.下列实验现象描述正确的是( )| A. | 硫粉在空气中燃烧时,发出蓝紫色火焰,生成具有刺激性气味的气体 | |
| B. | 将生石灰放入水中,液体的PH值不变 | |
| C. | 木炭在氧气中燃烧,生成黑色固体 | |
| D. | 将CO2通入紫色石蕊溶液中,溶液变为红色 |
分析 A、根据硫粉在空气中燃烧的现象进行分析判断.
B、根据将生石灰放入水中的现象进行分析判断.
C、根据木炭在氧气中燃烧的现象进行分析判断.
D、根据将CO2通入紫色石蕊溶液中的现象进行分析判断.
解答 解:A、硫粉在空气中燃烧时,发出淡蓝色火焰,生成具有刺激性气味的气体,故选项说法错误.
B、将生石灰放入水中,生成氢氧化钙,溶液显碱性,液体的pH值增大,故选项说法错误.
C、木炭在氧气中燃烧,发出白光,不生成黑色固体,故选项说法错误.
D、将CO2通入紫色石蕊溶液中,溶液变为红色,是因为二氧化碳和水反应生成碳酸的缘故,故选项说法正确.
故选:D.
点评 本题难度不大,掌握常见物质燃烧的现象即可正确解答,在描述物质燃烧的现象时,需要注意光和火焰、烟和雾的区别.

练习册系列答案
相关题目
5.某气体由H2、CO2、CO、CH4中的两种组成,为确定其成分进行了下面的实验:
①将气体通过澄清的石灰水,未出现浑浊现象;
②将气体通过灼热的氧化铜,有红色固体生成;
③将气体点燃后通入澄清的石灰水,有浑浊现象
那么对该气体成分作出的以下推断中,合理的是( )
①H2、CO ②CO、CH4 ③CO2、CH4 ④H2、CH4 ⑤H2、CO、CH4.
①将气体通过澄清的石灰水,未出现浑浊现象;
②将气体通过灼热的氧化铜,有红色固体生成;
③将气体点燃后通入澄清的石灰水,有浑浊现象
那么对该气体成分作出的以下推断中,合理的是( )
①H2、CO ②CO、CH4 ③CO2、CH4 ④H2、CH4 ⑤H2、CO、CH4.
| A. | ①②③④⑤ | B. | ①②④⑤ | C. | ①②④ | D. | ①② |
9.下列各组内表示同一种物质的是( )
| A. | 冰、干冰、二氧化碳 | B. | 氢氧化钙、熟石灰、石灰石 | ||
| C. | 盐酸、氯化氢、食盐 | D. | 烧碱、火碱、氢氧化钠 |
19.下列物质的用途,主要利用其物理性质的是( )
| A. | 氧气用于炼钢 | B. | 干冰作制冷剂 | ||
| C. | 一氧化碳用于炼铁 | D. | 稀盐酸除铁锈 |
6.下列化学方程式书写错误的是( )
| A. | H2O2$\frac{\underline{\;MnO_2\;}}{\;}$H2↑+O2↑ | B. | C+2CuO$\frac{\underline{\;高温\;}}{\;}$2Cu+CO2↑ | ||
| C. | CH4+2O2$\frac{\underline{\;点燃\;}}{\;}$CO2+2H2O | D. | FeCl3+3NaOH═Fe(OH)3↓+3NaCl |
3.下列各组物质中,前者不是后者溶质的是( )
| A. | 氯化氢、盐酸 | B. | 生石灰、石灰水 | ||
| C. | 碘、碘酒 | D. | 氢氧化钠、氢氧化钠溶液 |
4.活动小组同学通过Al,Fe,Cu三种金属与稀盐酸反应的实验,验证它们的活动性.
【所用药品】
溶质质量分数相同的稀盐酸,大小,形状相同的铝,铁,铜
【实验记录】
【分析与结论】
(1)实验开始时铝表面几乎无气泡产生的原因是铝表面有致密的氧化膜.
(2)铜表面始终无气泡产生的原因是铜不与酸反应(或铜在金属活动性顺序表中排在H之后).
(3)根据一段时间后三种金属与稀盐酸反应的现象,可证明三种金属的活动性由强到弱依次是Al>Fe>Cu
如图是小明配制100g溶质质量分数为12%的NaCl溶液的有关实验操作示意图.
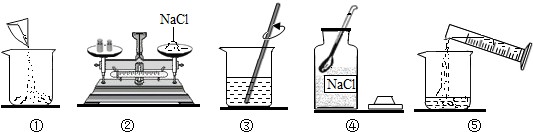
(1)配制过程中使用的四种玻璃仪器,分别是广口瓶、烧杯、玻璃棒、量筒.
(2)请你指出图中一处错误操作,并分析该操作可能造成的后果.②中物码放反了,会导致称取的氯化钠的质量减少.
(3)图②、图③表示的操作步骤分别是称量、溶解.
(4)配制时需称量氯化钠12g,如果氯化钠中含有少量不溶的杂质,溶质的质量分数会偏小(填“偏大”或“偏小”);量取水最好选择③的量筒(填序号①10mL②50mL③100mL).(水的密度为1g/cm3)
【所用药品】
溶质质量分数相同的稀盐酸,大小,形状相同的铝,铁,铜
【实验记录】
| Al | Fe | Cu | ||
| 现象 | 开始时 | 几乎无气泡产生 | 产生气泡速率慢 | 无气泡产生 |
| 一段时间后 | 产生气泡速率快 | 产生气泡速率慢 | 无气泡产生 |
(1)实验开始时铝表面几乎无气泡产生的原因是铝表面有致密的氧化膜.
(2)铜表面始终无气泡产生的原因是铜不与酸反应(或铜在金属活动性顺序表中排在H之后).
(3)根据一段时间后三种金属与稀盐酸反应的现象,可证明三种金属的活动性由强到弱依次是Al>Fe>Cu
如图是小明配制100g溶质质量分数为12%的NaCl溶液的有关实验操作示意图.

(1)配制过程中使用的四种玻璃仪器,分别是广口瓶、烧杯、玻璃棒、量筒.
(2)请你指出图中一处错误操作,并分析该操作可能造成的后果.②中物码放反了,会导致称取的氯化钠的质量减少.
(3)图②、图③表示的操作步骤分别是称量、溶解.
(4)配制时需称量氯化钠12g,如果氯化钠中含有少量不溶的杂质,溶质的质量分数会偏小(填“偏大”或“偏小”);量取水最好选择③的量筒(填序号①10mL②50mL③100mL).(水的密度为1g/cm3)