题目内容
6.某科学兴趣小组的同学,为了探究过氧化钠(Na2O2)和CO2的化学反应设计了如图的实验
[实验步骤]:
①按上图装配好装置,检查整套装置的气密性;
②把相关的试剂放入对应的仪器内
③推动针筒的活塞,把稀盐酸注入试管内,并固定活塞位置
④一段时间后,在a处放置一根带火星的小木条,观察现象.
[实验现象]:
①a处带火星的小木条复燃;
②D处澄清石灰水变浑浊
(1)a处的木条复燃,说明了Na2O2和CO2的反应产物中有氧气
(2)资料:①过氧化钠能和水反应生成氢氧化钠和氧气②氢氧化钙的溶解度随温度的升高而减小
你认为该实验中装置C的作用是检验二氧化碳气体中是否含有水蒸气.D装置烧杯内饱和澄清石灰水变浑浊的原因是过氧化钠和二氧化碳反应时放出热量,澄清石灰水温度升高,部分氢氧化钙析出.
分析 氧气能使带火星的木条复燃;
浓硫酸具有吸水性,可以用来干燥氢气、氧气、二氧化碳等气体;
无水硫酸铜是白色固体,能和水反应生成蓝色五水硫酸铜;
根据澄清石灰水的变化可以判断反应是否放热.
解答 解:(1)a处的木条复燃,说明了Na2O2和CO2的反应产物中有氧气.
故填:氧气.
(2)该实验中装置C的作用是:检验二氧化碳气体中是否含有水蒸气,以排出水蒸气对实验的干扰;
D装置烧杯内饱和澄清石灰水变浑浊的原因是:过氧化钠和二氧化碳反应时放出热量,澄清石灰水温度升高,部分氢氧化钙析出,导致溶液变浑浊.
故填:检验二氧化碳气体中是否含有水蒸气;过氧化钠和二氧化碳反应时放出热量,澄清石灰水温度升高,部分氢氧化钙析出.
点评 实验现象是物质之间相互作用的外在表现,因此要学会设计实验、观察实验、分析实验,为揭示物质之间相互作用的实质奠定基础.

练习册系列答案
相关题目
16.“鱼浮灵”主要成分是过碳酸钠(xNa2CO3•yH2O2),俗称固体双氧水.兴趣小组对其进行以下探究:
【性质探究】
(1)取少量“鱼浮灵”于试管中加水,有持续细小气泡缓慢放出;向试管中加入少量MnO2粉末,产生大量气泡.将带火星木条伸入试管,木条复燃,说明有O2生成.
(2)取实验(1)中上层清液,测得溶液pH>7;向溶液中滴加足量稀盐酸,产生大量气泡;将产生的气体通入澄清石灰水中,出现浑浊现象,说明有二氧化碳生成.
结论:过碳酸钠具有Na2CO3和H2O2的双重化学性质.
【工业制备】
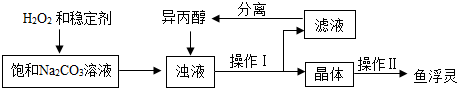
注:异丙醇为有机溶剂.
(3)稳定剂的作用是防止过碳酸钠分解;稳定剂中MgCl2和Na2SiO3发生复分解反应,生成一种难溶物将过碳酸钠粒子包裹住,该反应的化学方程式为MgCl2+Na2SiO3=MgSiO3↓+2NaCl.
(4)浊液中加入异丙醇的作用是减少过碳酸钠的溶解.
(5)操作Ⅱ中洗涤晶体的试剂最好选用C(填字母).
A.饱和NaCl溶液 B水 C异丙醇 D稀盐酸
(6)根据下表数据,你认为上述制备反应的最佳温度范围是15~20℃.
注:活性氧含量是指产品中能转化为O2的氧元素的质量分数.
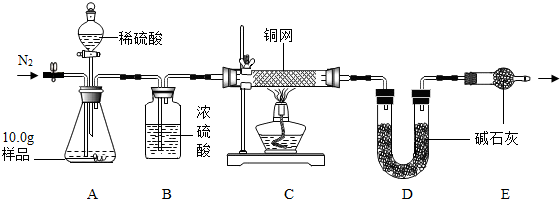
【组成测定】利用下图装置进行产品中活性氧含量测定和过碳酸钠(xNa2CO3•yH2O2)组成的测定(杂质对测定无影响).
查阅资料:①“鱼浮灵”中活性氧含量≥13.0%是一等品,≥10.5%是合格品.
②过碳酸钠能与酸反应放出CO2和O2.
(7)实验前先缓慢通N2一段时间,加热铜网至红热后,再缓慢滴入过量稀硫酸,直至A中样品完全反应;继续缓慢通N2,其目的是实验前通氮气是为了除去装置内的空气,以防测定值偏高;实验后还要继续通氮气是为了使残留在装置中的气体全部被吸收.
(8)若先滴入稀硫酸,后加热铜网,会导致x:y的值偏大(填“偏大”或“偏小”).
(9)装置B的作用是①②(填序号)
①除去气体中的水蒸气 ②便于观察和控制气流速度
(10)实验测得C装置中铜网增重1.2g,D装置增重2.2g.该产品中活性氧含量为12%%;属于合格品(填“一等品”或“合格品”);x:y=2:3.
【性质探究】
(1)取少量“鱼浮灵”于试管中加水,有持续细小气泡缓慢放出;向试管中加入少量MnO2粉末,产生大量气泡.将带火星木条伸入试管,木条复燃,说明有O2生成.
(2)取实验(1)中上层清液,测得溶液pH>7;向溶液中滴加足量稀盐酸,产生大量气泡;将产生的气体通入澄清石灰水中,出现浑浊现象,说明有二氧化碳生成.
结论:过碳酸钠具有Na2CO3和H2O2的双重化学性质.
【工业制备】

注:异丙醇为有机溶剂.
(3)稳定剂的作用是防止过碳酸钠分解;稳定剂中MgCl2和Na2SiO3发生复分解反应,生成一种难溶物将过碳酸钠粒子包裹住,该反应的化学方程式为MgCl2+Na2SiO3=MgSiO3↓+2NaCl.
(4)浊液中加入异丙醇的作用是减少过碳酸钠的溶解.
(5)操作Ⅱ中洗涤晶体的试剂最好选用C(填字母).
A.饱和NaCl溶液 B水 C异丙醇 D稀盐酸
(6)根据下表数据,你认为上述制备反应的最佳温度范围是15~20℃.
| 温度范围/℃ | 5~10 | 10~15 | 15~20 | 20~25 |
| 活性氧含量/% | 13.94 | 14.02 | 15.05 | 14.46 |
| “鱼浮灵”的产率/% | 85.49 | 85.78 | 88.38 | 83.01 |
【组成测定】利用下图装置进行产品中活性氧含量测定和过碳酸钠(xNa2CO3•yH2O2)组成的测定(杂质对测定无影响).

查阅资料:①“鱼浮灵”中活性氧含量≥13.0%是一等品,≥10.5%是合格品.
②过碳酸钠能与酸反应放出CO2和O2.
(7)实验前先缓慢通N2一段时间,加热铜网至红热后,再缓慢滴入过量稀硫酸,直至A中样品完全反应;继续缓慢通N2,其目的是实验前通氮气是为了除去装置内的空气,以防测定值偏高;实验后还要继续通氮气是为了使残留在装置中的气体全部被吸收.
(8)若先滴入稀硫酸,后加热铜网,会导致x:y的值偏大(填“偏大”或“偏小”).
(9)装置B的作用是①②(填序号)
①除去气体中的水蒸气 ②便于观察和控制气流速度
(10)实验测得C装置中铜网增重1.2g,D装置增重2.2g.该产品中活性氧含量为12%%;属于合格品(填“一等品”或“合格品”);x:y=2:3.
17.同学们用Na2CO3溶液和浓盐酸来研究简易灭火器的反应原理时,对反应后废液的成分进行探究.上述两种物质发生反应的化学方程式为Na2CO3+2HCl═2NaCl+H2O+CO2↑,由此判断废液中溶质一定有NaCl(NaCl溶液呈中性),设计一个简单的实验确定废液中另一成分是Na2CO3还是盐酸.
(1)用向废液中逐滴加入经过酸化的AgNO3溶液来确定废液中另一成分是Na2CO3还是盐酸,此方法不可行的原因NaCl+AgNO3═AgCl↓+NaNO3(用化学方程式说明).
(2)后续实验操作是玻璃棒蘸起废液涂在PH试纸上,再与比色卡对照测出废液的pH大于7,确定废液中一定含有Na2CO3.
(3)欲从废液中得到纯净的NaCl,请完成右表格实验方案设计.
(1)用向废液中逐滴加入经过酸化的AgNO3溶液来确定废液中另一成分是Na2CO3还是盐酸,此方法不可行的原因NaCl+AgNO3═AgCl↓+NaNO3(用化学方程式说明).
| 方案 | 加入试剂 | 分离方法 | 方案评价 |
| 1 | 适量Ca(NO3)2溶液 | 过滤、蒸发、结晶 | 不可行,理由是引入了新杂质硝酸钠 |
| 2 | 过量的稀盐酸 | 蒸发结晶 | 可行 |
(3)欲从废液中得到纯净的NaCl,请完成右表格实验方案设计.
1.厨房里发生的化学变化中,属于物理变化的是( )
| A. |  煤气燃烧 | B. |  面包发霉 | C. |  榨取果汁 | D. |  菜刀生锈 |
11.时下有些年轻人喜欢染发,一般要用到一种着色剂--对苯二胺,其化学式为C6H8N2.它是一种有毒的化学药品,会对者的身体带来伤害.下列有关对苯二胺的说法不正确的是( )
| A. | 每个对苯二胺分子由16个原子组成 | |
| B. | 对苯二胺由碳、氢、氮三种元素组成 | |
| C. | 对苯二胺分子中含有氮分子N2 | |
| D. | 对苯二胺分子中质量分数最大的是碳元素 |
2.实验室制取H2有以下步骤:①连接好装置;②向试管中小心放入几粒锌;③向试管中小心注入适量稀盐酸;④检查装置的气密性;⑤收集产生的气体;⑥检验氢气的纯度.以上操作按由先至后的顺序排列正确的是( )
| A. | ①②③④⑤⑥ | B. | ①④②③⑥⑤ | C. | ①③②④⑥⑤ | D. | ③①④②⑤⑥ |
19.甲.乙两种化合物都只含X.Y两种元素,甲.乙中X元素的质量分数分别为a%和b%(a%<b%).已知甲的化学式为XY,则乙的化学式可能为( )
| A. | X2Y | B. | XY2 | C. | X2Y3 | D. | X2Y5 |
