题目内容
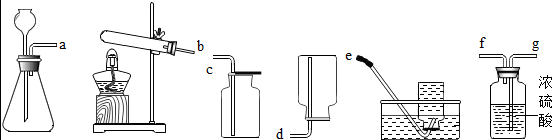
4.如图所示为实验室常见气体制备,净化、干燥、收集和性质实验的部分仪器(组装实验装置时,可重复选择仪器).某学校两个化学实验探究小组的同学欲用他们完成各自的探究实验
(1)第一组的同学以石灰水和稀盐酸为原料,在实验室中制备、收集干燥、纯净的二氧化碳气体,按照要求设计实验装置、连接仪器(提示:挥发出的少量HCl气体可用饱和碳酸氢钠溶液吸收).
①所选仪器的连接顺序为A→C→B→E(填写仪器序号字母).
②写出实验室制取二氧化碳的化学方程式CaCO3+2HCl=CaCl2+H2O+CO2↑
③若将二氧化碳通入澄清的石灰水中,石灰水的pH将减小(填“增大”“减小”“不变”之一).
④写出用碳酸氢钠溶液吸收氯化氢气体的方程式NaHCO3+HCl=NaCl+H2O+CO2↑
(2)第二组的同学以过氧化氢溶液为原料(MnO2为催化剂)制备氧气,试回答下列问题:
①实验室制备氧气可选取AE装置
②怎样验氧气是否收集满了将带火星的木条放在集气瓶口,木条复燃,证明集满.
分析 (1)实验室通常用大理石或石灰石和稀盐酸反应制取二氧化碳,反应不需要加热,大理石和石灰石的主要成分是碳酸钙,能和稀盐酸反应生成氯化钙、水和二氧化碳;浓硫酸具有吸水性,可以用来干燥二氧化碳、氧气、氢气等气体;碳酸氢钠和盐酸反应会生成氯化钠、水和二氧化碳,二氧化碳和氢氧化钙反应会生成碳酸钙沉淀和水等知识进行分析;
(2)根据实验室用过氧化氢制取氧气的反应物是固体和液体,反应条件是常温,氧气的密度比空气大,有助燃性进行分析.
解答 解:(1)①实验室通常用大理石或石灰石和稀盐酸反应制取二氧化碳,反应不需要加热,大理石和石灰石的主要成分是碳酸钙,制取的二氧化碳气体中含有氯化氢气体和水蒸气,需要用碳酸氢钠吸收氯化氢,用浓硫酸吸收水分,所以所选仪器的连接顺序为A→C→B→E;
②碳酸钙和稀盐酸反应生成氯化钙、水和二氧化碳,化学方程式为:CaCO3+2HCl=CaCl2+H2O+CO2↑;
③二氧化碳和氢氧化钙反应会生成碳酸钙沉淀和水,所以石灰水的pH将减小;
④碳酸氢钠和盐酸反应会生成氯化钠、水和二氧化碳,化学方程式为:NaHCO3+HCl=NaCl+H2O+CO2↑;
(2)①实验室用过氧化氢制取氧气的反应物是固体和液体,反应条件是常温,氧气的密度比空气大,所以实验室制备氧气可选取AE;
②氧气有助燃性,所以检验氧气是否集满的方法是:将带火星的木条放在集气瓶口,木条复燃,证明集满.
故答案为:(1)①A→C→B→E;
②CaCO3+2HCl=CaCl2+H2O+CO2↑;
③减小;
④NaHCO3+HCl=NaCl+H2O+CO2↑;
(2)①AE;
②将带火星的木条放在集气瓶口,木条复燃,证明集满.
点评 合理设计实验,科学地进行实验、分析实验,是得出正确实验结论的前提,因此要学会设计实验、进行实验、分析实验,为学好化学知识奠定基础.

 阅读快车系列答案
阅读快车系列答案| A. | 4:1 | B. | 3:1 | C. | 2:1 | D. | 1:1 |
| A. | 偏向右边 | B. | 偏向左边 | C. | 中间 | D. | 无法确定 |
| A. | 水烧开后易把壶盖冲起-温度升高分子间隔变大 | |
| B. | 墙内开药墙外香-分子在不断运动 | |
| C. | 盐酸、硫酸都具有酸的通性-它们在水溶液中都能电离出H+ | |
| D. | 铝及其合金是电气、工业家庭广泛使用的材料-铝比铁更活泼 |
| A. | 洁净的空气 | B. | 蒸馏水 | C. | 新鲜的牛奶 | D. | 可口的饮料 |
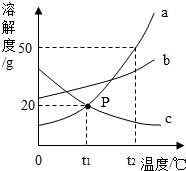 如图是a、b、c三种物质的溶解度曲线,a与c的溶解度曲线相交于P点.据图回答:
如图是a、b、c三种物质的溶解度曲线,a与c的溶解度曲线相交于P点.据图回答: