题目内容
15.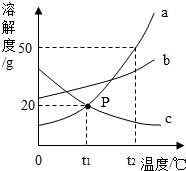 如图是a、b、c三种物质的溶解度曲线,a与c的溶解度曲线相交于P点.据图回答:
如图是a、b、c三种物质的溶解度曲线,a与c的溶解度曲线相交于P点.据图回答:(1)t2℃时a、b、c三种物质的溶解度按由小到大的顺序排列是c<b<a(填写物质序号).
(2)要将B物质从它的饱和溶液中析出,就采用的方法是加热(填“冷却”或“加热”)
分析 根据物质的溶解度曲线可以判断某一温度时物质溶解度的大小;
从溶液中结晶的方法有两种:蒸发结晶和降温结晶,物质的溶解度受温度变化影响较小时,应该用蒸发结晶;物质的溶解度受温度变化影响较大时,应该用降温结晶.
解答 解:(1)由溶解度曲线可知,t2℃时a、b、c三种物质的溶解度按由小到大的顺序排列是c<b<a.
故填:c<b<a.
(2)由溶解度曲线可知,b物质的溶解度受温度变化影响较小,要将b物质从它的饱和溶液中析出,应该用加热蒸发溶剂的方法.
故填:加热.
点评 溶解度曲线能定量地表示出溶解度变化的规律,从溶解度曲线可以看出:同一溶质在不同温度下的溶解度不同;同一温度下,不同溶质的溶解度可能相同,也可能不同;温度对不同物质的溶解度影响不同.

练习册系列答案
相关题目
5.配制100g溶质质量分数为25.5%的KNO3溶液.以下操作会引起溶质质量分数偏低的是( )
| A. | 用托盘天平称量25.5g KNO3时,误将砝码放在左盘(注:砝码最小值为1g,1g以下用游码) | |
| B. | 用量筒量取水时,俯视凹液面的最低处读数 | |
| C. | 将量筒中的水倒入烧杯时,有少量水溅出 | |
| D. | 将配制好的溶液转移到细口瓶时,不慎有少量洒落瓶外 |
6.欲将下列物质中(括号内为杂质)的杂质除去所用试剂的方法正确的是( )
| A. | O2(CO2),用NaOH溶液吸收 | B. | Zn(Cu),用过量的稀盐酸溶解后过滤 | ||
| C. | NaCl(Na2CO3),加入适量稀硫酸、蒸发 | D. | CO2(CO),用点燃的方法除去 |
3.下列各项完全正确的是( )
| A. | 生石灰-CaO-氧化物 | B. | 纯碱-Na2CO3-碱 | ||
| C. | 水银-Ag-单质 | D. | 石灰石-CaCO3-酸 |
7.化学实验中常常会出现意外情况,这是提升我们学科素养的良好机会,要根据具体情况区别对待,善于发现和解决问题.例如:用盐酸和碳酸钙固体反应,将得到的气体X通入澄清石灰水中,始终没有发现石灰水变浑浊.针对此现象,同学们提出了自己的想法和做法,请你帮助他们完成以下探究.
【假设】小英的假设:澄清石灰水已变质
小青的假设:气体X中除了有CO2外,还有氯化氢或HCl气体
【实验探究】
Ⅰ.小英的探究:
Ⅱ.小青的探究
【实验反思】
Ⅲ.同学们经过讨论发现,只用一组实验装置就可以同时完成上述两个假设的探究.请你从下图中选择一组合理的装置A(填序号).

Ⅳ.在上述合理装置的第二支试管内应放入AgNO3溶液,其作用是验证氯化氢气体是否已除尽.
【假设】小英的假设:澄清石灰水已变质
小青的假设:气体X中除了有CO2外,还有氯化氢或HCl气体
【实验探究】
Ⅰ.小英的探究:
| 实验目的 | 实验步骤 | 可能的实验现象 | 化学方程式和实验结沦 |
| 探究所用 澄清石灰 水是否变 质 | ①用一支试管另取少 量原澄清石灰水 ②取稀硫酸与碳酸钠 反应制取CO2 ③将产生的气体通入所用澄清石灰水中 | 步骤③中现象为: 石灰水未变浑浊 | 步骤②中反应方程式为: H2SO4+Na2CO3=Na2SO4+H2O+CO2↑ 步骤③可能的反应方程式略 实验结论: 所用澄清石灰水已变质 |
| 实验目的 | 实验步骤 | 实验现象 | 化.学方程式和实验结论 |
| 探究气体X 中是否含有 HCl气体 | 将气体X通入硝酸银 溶液 | 有白色沉淀生成 | 反应方程式为:HCl+AgNO3=AgCl↓+HNO3 实验结论:气体X中含有 HCl气体 |
Ⅲ.同学们经过讨论发现,只用一组实验装置就可以同时完成上述两个假设的探究.请你从下图中选择一组合理的装置A(填序号).

Ⅳ.在上述合理装置的第二支试管内应放入AgNO3溶液,其作用是验证氯化氢气体是否已除尽.
 根据如图回答问题
根据如图回答问题
