题目内容
8. 如图是稀释浓硫酸实验的示意图.
如图是稀释浓硫酸实验的示意图.(1)a仪器的名称烧杯,a仪器中所盛的试剂是浓硫酸(填“水”或“浓硫酸”).稀释后手接触b仪器会感觉发热;稀释时若两种试剂添加顺序颠倒,将会发生酸液飞溅.
(2)将10g溶质质量分数为98%的浓硫酸配制成100g稀硫酸,所得溶液中溶质的质量分数是9.8%;用量筒量取蒸馏水时,若俯视读数,则会导致配制的稀硫酸的溶质质量分数偏大(填“偏大”或“偏小”或“不变”).
(3)据媒体报道,有一村民误将稀硫酸当白酒喝下,造成食道和胃严重损伤,这是因为稀硫酸具有腐蚀性.这件事警示我们,家中存放或使用药品时应注意存放时要贴好标签,放在安全地方(或使用时要核对标签).
分析 (1)根据实验室常见仪器的名称和用途填空;根据浓硫酸的性质以及浓硫酸稀释需注意事项进行解答.
(2)运用稀释前后溶质质量不改变,量筒读数时俯视会使量取的水的量偏小,所以配制的溶液中溶剂质量偏小,溶液中溶质质量分数偏大解答.
(3)根据熟记稀硫酸具有的性质:腐蚀性.家中存放或使用药物时应注意:存放时要贴好标签,放在安全地方(或使用时要核对标签)解答.
解答 解:
(1)图中a的名称是烧杯;故填:玻璃棒、量筒;稀释浓硫酸时,要把浓硫酸沿着容器壁缓缓注入水中,并用玻璃棒不断搅拌;故填:浓硫酸;
由于浓硫酸的密度比水大,如果稀释时添加顺序颠倒,那么水会浮在水面上,又由于浓硫酸溶于水放出大量的热,足以使水沸腾,所以容易造成酸液飞溅的情形出现;
(2)浓硫酸中溶质质量:10g×98%=9.8g,要配制的溶液的质量分数为:$\frac{9.8g}{100g}×$100%=9.8%,量筒读数时俯视会使量取的水的量偏小,所以配制的溶液中溶剂质量偏小,溶液中溶质质量分数偏大;
(3)由题意:一村民在家里误将装在酒瓶的稀硫酸当成白酒喝下,造成食道和胃严重损伤,这是因为稀硫酸具有:腐蚀性.这一事件警示我们,家中存放或使用药物时应注意:存放时要贴好标签,放在安全地方(或使用时要核对标签).
答案:
(1)烧杯 浓硫酸 发热 酸液飞溅
(2)9.8% 偏大
(3)腐蚀性 存放时要贴好标签,放在安全地方(或使用时要核对标签)
点评 浓硫酸遇水会放出大量的热,又因为浓硫酸的密度比水大,因此稀释浓硫酸时应该把浓硫酸慢慢的注入到水中,并用玻璃棒不断的搅拌,使产生的热量及时的散发掉.

练习册系列答案
相关题目
19.下列物质的 组成和结构决定性质,性质决定用途.下列叙述正确的是( )
| A. | 尿素[CO(NH2)2],HNO3,NH4HCO3中都含有氮元素,可用作氮肥 | |
| B. | 用氢氧化钙改良酸性土壤 | |
| C. | 生铁坚硬,可以作医疗手术器械 | |
| D. | 洗洁精可以加速油污溶解,可以除去油污 |
16. 如图,甲、乙两个装置均可通过胶头滴管向锥形瓶中滴加某种液体,达到使气球鼓起的目的,锥形瓶和胶头滴管放入物质正确的一组是 ( )
如图,甲、乙两个装置均可通过胶头滴管向锥形瓶中滴加某种液体,达到使气球鼓起的目的,锥形瓶和胶头滴管放入物质正确的一组是 ( )
 如图,甲、乙两个装置均可通过胶头滴管向锥形瓶中滴加某种液体,达到使气球鼓起的目的,锥形瓶和胶头滴管放入物质正确的一组是 ( )
如图,甲、乙两个装置均可通过胶头滴管向锥形瓶中滴加某种液体,达到使气球鼓起的目的,锥形瓶和胶头滴管放入物质正确的一组是 ( )| 序号 | A | B | C | D | ||||
| 装置名称 | 甲 | 乙 | 甲 | 乙 | 甲 | 乙 | 甲 | 乙 |
| 锥形瓶内物质 | HCl气体 | NaCl固体 | NaCl | 固体NaOH | NH3 | Cu | CO2 | 锌粒 |
| 胶头滴管中物质 | NaOH溶液 | H2O | 盐酸 | H2O | H2O | 稀盐酸 | NaOH溶液 | 稀硫酸 |
| A. | A | B. | B | C. | C | D. | D |
13.下列实验操作、实验现象和实验结论均正确的一组是( )
| 实验操作 | 实验现象 | 实验结论 | |
| A | 将某气体燃烧,在火焰上方罩一个冷而干燥的烧杯 | 烧杯内壁有水珠生成 | 该气体一定为氢气 |
| B | 用带火星的木条伸入盛有某无色气体的集气瓶中 | 木条复燃 | 该无色气体为氧气 |
| C | 向某固体中滴加稀硫酸 | 产生气泡 | 该固体中一定含有碳酸盐 |
| D | 将水注入盛有浓硫酸的烧杯中 | 烧杯外壁发烫 | 浓硫酸溶于水放出热量 |
| A. | A | B. | B | C. | C | D. | D |
20.下列有关说法正确的是( )
| A. | 由O2的沸点为-183℃,SO2的沸点为-12℃可知,O2比SO2易液化 | |
| B. | 酸碱指示剂遇酸或碱均会变色 | |
| C. | 打开盛浓盐酸的试剂瓶盖,看到冒白雾,说明浓盐酸易挥发,HCl气体易溶于水 | |
| D. | 实验室除食盐、蔗糖等少数厨房用品外,不得尝药品的味道 |




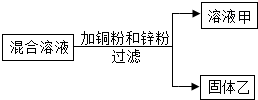 某化学小组用一定量AgNO3和Al(NO3)3的混合溶液加入铜粉和锌粉,充分反应后过滤,得到溶液甲和固体乙,如图所示,则:
某化学小组用一定量AgNO3和Al(NO3)3的混合溶液加入铜粉和锌粉,充分反应后过滤,得到溶液甲和固体乙,如图所示,则: