题目内容
工业上高温煅烧石灰石制取生石灰,发生反应的化学方程式为:CaCO3
CaO+CO2↑.若要制取2.8吨生石灰(不含杂质),至少需要含杂质10%(杂质不参加反应)的石灰石多少吨?(结果保留一位小数)
| ||
考点:含杂质物质的化学反应的有关计算
专题:有关化学方程式的计算
分析:将生石灰的质量代入碳酸钙分解的反应方程式来计算碳酸钙的质量,然后利用碳酸钙的质量分数来计算石灰石的质量.
解答:解:设用去的碳酸钙的质量为x,
CaCO3
CaO+CO2↑
100 56
x 2.8t
=
x=5.0t
则需要含杂质10%(杂质不参加反应)的石灰石的质量为
≈5.6t,
答:需要含杂质10%的石灰石质量为5.6t.
CaCO3
| ||
100 56
x 2.8t
| 100 |
| 56 |
| x |
| 2.8t |
x=5.0t
则需要含杂质10%(杂质不参加反应)的石灰石的质量为
| 5.0t |
| 90% |
答:需要含杂质10%的石灰石质量为5.6t.
点评:本题考查学生利用化学反应方程式的计算,应明确纯物质的纯质量才能代入化学反应方程式来计算,并注意计算格式的规范和清晰的解答思路.

练习册系列答案
相关题目


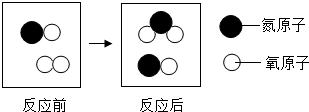
 和生成
和生成 的质量比为
的质量比为