题目内容
9.某同学在课外活动中用铁粉(含杂质且杂质不参加反应)和稀硫酸反应制取氢气.所做5次实验结果记录如下表(每次实验产生的氢气全部被收集,且体积在相同条件下测定.该条件下氢气的密度是0.089g/L).| 实验编号 | 铁粉的质量/g | 稀硫酸的质量/g | 生成氢气的体积/L |
| 1 | 2.0 | 50.0 | 0.77 |
| 2 | 4.0 | 50.0 | 1.54 |
| 3 | 5.8 | 50.0 | 2.24 |
| 4 | 5.8 | 60.0 | 2.24 |
| 5 | 6.4 | 50.0 | 2.24 |
(1)上述实验中,铁粉一定过量的实验编号是5;
(2)计算稀硫酸的质量分数(要求写出计算过程,计算结果精确到0.1).
分析 (1)根据实验3和实验5可以看出同样是50g稀硫酸,与不同质量的铁粉反应放出氢气的体积相等,说明在第五次实验中加入的铁粉是过量的;
(2)比较实验3和实验5,不同质量的铁粉与等质量的硫酸反应生成氢气的质量相等,说明此时硫酸的已经被完全消耗,即50g硫酸只能产生2.24L氢气,比较实验3和实验4,同质量的铁粉和不同质量的硫酸反应生成氢气的质量相等,说明此时铁粉已被完全消耗,即5.8g铁只能产生2.24L氢气,综合两方面的分析可以知道5.8g铁粉和50g硫酸恰好完全反应,即实验3是恰好完全反应的,故可以根据实验3的数据完成计算
解答 解:(1)比较实验3和实验5可知:同样是50g稀硫酸,与不同质量的金属反应放出氢气的体积相等,所以可以判断实验5中的金属是过量的;
根据表中所给数据分析,确定3组实验恰好完全反应
(2)设生成2.24 L氢气需H2S04的质量为x,则:
Fe+H2S04═FeS04 +H2↑
98 2
x 2.24 L×0.089 g/L
$\frac{98}{x}$=$\frac{2}{2.24L×0.089g/L}$
解得:x=9.8g
稀硫酸的质量分数=$\frac{9.8g}{50g}$×l00%=19.6%;
答:稀硫酸的质量分数是19.6%.
故答案为:(1)5;
(2)19.6%
点评 综合分析数据,找出量之间的关系分析反应物与生成物之间的质量关系,分析出物质的剩余,选择计算的数据一定是被完全反应的物质,这样才可以正确求出相应的未知量.

练习册系列答案
相关题目
9.在一定条件下,一个密闭容器内发生某反应,测得反应前后各物质的质量如下表所示.下列有关说法不正确的是( )
| 物质 | a | b | c | d |
| 反应前的质量/g | 30 | 20 | 10 | 15 |
| 反应后的质量/g | X | y | 0 | 10 |
| A. | 参加反应的c与d的质量比为2:1 | B. | x的取值范围:0≤x≤30 | ||
| C. | 当y≤20时,该反应一定是化合反应 | D. | x+y=65 |
4.分类是学习和研究化学的常用方法.下列分类正确的是( )
| A. | 蒸馏水和矿泉水:硬水 | B. | 金刚石和石墨:碳单质 | ||
| C. | 生铁和玻璃钢:金属材料 | D. | 氧化钾和碳酸氢铵:盐类 |
1.2015年两会期间,环境问题成了热议的话题之一.近几年来,雾霾在我国多地频发,雾霾可导致呼吸系统疾病人增多,因为雾霾可使空气中增加大量的( )
| A. | 二氧化碳 | B. | 一氧化碳 | C. | 二氧化碳 | D. | 可吸入颗粒物 |
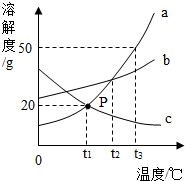 如图是a、b、c三种物质(均不含结晶水)的溶解度曲线,请填空:
如图是a、b、c三种物质(均不含结晶水)的溶解度曲线,请填空: 根据如图回答下列问题:
根据如图回答下列问题: