题目内容
19.已知某碘盐的主要成分为氯化钠和碘酸钾(KIO3):①氯化钠含有的阴离子是Cl-(用符号表示),KIO3中I的化合价为+5.
②用试剂X测定该碘盐中碘元素的含量,发生如下反应:
KIO3+5X+3H2SO4=3K2SO4+3I2+3H2O,推算X的化学式为KI.
分析 ①氯化钠中的阴离子是氯离子,写出其离子符号即可;根据在化合物中正负化合价代数和为零,进行分析解答.
②由质量守恒定律:反应前后,原子种类、数目均不变,据此由反应的化学方程式推断反应物X的化学式.
解答 解:①氯化钠中的阴离子是氯离子,其离子符号为:Cl-.
钾元素显+1价,氧元素显-2价,设碘元素的化合价是x,根据在化合物中正负化合价代数和为零,可得:(+1)+x+(-2)×3=0,则x=+5价.
②由质量守恒定律:反应前后,原子种类、数目均不变,由反应的化学方程式KIO3+5X+3H2SO4=3K2SO4+3I2+3H2O,反应前钾、碘、氧、氢、硫原子个数分别为1、1、15、6、3,反应后的生成物中钾、碘、氧、氢、硫原子个数分别为6、6、15、6、3,根据反应前后原子种类、数目不变,则5X分子中含有5个钾原子和5个碘原子,则每个X分子由1个钾原子和1个碘原子构成,则物质X的化学式为KI.
故答案为:①Cl-;+5;②KI.
点评 本题难度不大,掌握离子符号的书写方法、化合价的原则、化学反应前后原子守恒来确定物质的化学式是正确解答本题的关键.

练习册系列答案
相关题目
10.下列过程中的质量变化问题不能用质量守恒定律来解释的是( )
| A. | 24克镁带在氧气中完全燃烧后得到的固体质量为40克 | |
| B. | 480克木柴在空气中完全燃烧后剩余固体质量为36克 | |
| C. | 20克食盐完全溶解于100克水后得到盐水质量为120克 | |
| D. | 100克过氧化氢溶液完全分解后得到96.8克水和3.2克氧气 |
7.如图是元素X 的原子结构示意图,下列说法正确的是( )
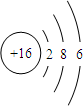

| A. | 该原子的核内电子数为16 | B. | 该原子最外电子层达到了稳定结构 | ||
| C. | X 属于非金属元素 | D. | X 与Na 生成化合物NaX |
14.金属冶炼就是要把金属从化合态变成游离态,使金属氧化物还原成金属单质,如图为有关实验室用一氧化碳还原氧化铜的实验装置,装置乙中的溶液为澄清石灰水,请回答与该实验有关的问题:

(1)实验时,从甲装置的玻璃管中观察到
的现象是黑色固体变成红色
(2)装置乙中发生反应的化学方程式是CO2+Ca(OH)2=CaCO3↓+H2O
(3)现有含杂质的氧化铜样品10g(假设杂质不参加反应),为测定该样品中氧化铜的质量分数,某同学用如图所示的装置进行实验,得到下列两组数据:
关于这两组数据,下列说法不正确的是BD(选填相关的字母)
A、玻璃管中固体减少的质量即为氧化铜中氧元素的质量
B、利用这两个数据都可以计算出样品中氧化铜的质量分数
C、装置乙中石灰水增重的质量与反应产生二氧化碳的质量不相等
D、如果实验称量很准确,则玻璃管中固体减少的质量应等于装置乙中石灰水增重的质量
(4)通过计算该样品中氧化铜的质量分数为90%.

(1)实验时,从甲装置的玻璃管中观察到
的现象是黑色固体变成红色
(2)装置乙中发生反应的化学方程式是CO2+Ca(OH)2=CaCO3↓+H2O
(3)现有含杂质的氧化铜样品10g(假设杂质不参加反应),为测定该样品中氧化铜的质量分数,某同学用如图所示的装置进行实验,得到下列两组数据:
| 反应前 | 氧化铜完全反应后 | |
| Ⅰ组 | 洗气瓶和石灰水的质量为185g | 洗气瓶和瓶内物质的总质量为187g |
| Ⅱ组 | 玻璃管和氧化铜样品的质量为57.9g | 玻璃管和玻璃管内物质的质量为56.1g |
A、玻璃管中固体减少的质量即为氧化铜中氧元素的质量
B、利用这两个数据都可以计算出样品中氧化铜的质量分数
C、装置乙中石灰水增重的质量与反应产生二氧化碳的质量不相等
D、如果实验称量很准确,则玻璃管中固体减少的质量应等于装置乙中石灰水增重的质量
(4)通过计算该样品中氧化铜的质量分数为90%.
11.对于化学反应A+B=C+D的下列说法中,正确的是( )
| A. | 若C、D分别为单质和化合物,则该反应一定是置换反应 | |
| B. | 若C、D分别为盐和水,则该反应一定是中和反应 | |
| C. | 若A、B、C、D都是化合物,该反应一定是复分解反应 | |
| D. | 若A为碱溶液,B为盐溶液,则C和D可能是两种沉淀 |
17.下列各组物质,属于同一种物质的是( )
| A. | 生石灰、熟石灰 | B. | 纯碱、烧碱 | C. | 苏打、纯碱 | D. | 大理石、碳酸钙 |


 如图是关于铜及其化合物的知识网络图,“→”表示一种物质转化成另一种物质.A、B、C分别是不同类别的铜的化合物,其中A物质为黑色粉末,B物质易溶于水.
如图是关于铜及其化合物的知识网络图,“→”表示一种物质转化成另一种物质.A、B、C分别是不同类别的铜的化合物,其中A物质为黑色粉末,B物质易溶于水.