题目内容
13. 某兴趣小组利用如图装罝(省略夹持仪器)探究二氧化碳与氢氧化钠溶液的反应
某兴趣小组利用如图装罝(省略夹持仪器)探究二氧化碳与氢氧化钠溶液的反应【实验步骤】
①将足量的氢氧化钠浓溶液装入分液漏斗中.
②打开止水夹K1,待氢氧化钠浓溶液完全进入广口瓶之后立即关闭K2.
③待充分反应后,打开止水夹K2
【实验现象】
整个实验过程中,观察到注射器中的液体液体自动喷出或自动喷入U型管或进入U型管.U型管中液体变红,并有部分液体沿导管进入广口瓶,广口瓶中的液体出现浑浊.
【实验解释】
步骤②中发生反应的化学方程式为CO2+2NaOH=Na2CO3+H2O.产生上述现象的原因二氧化碳与氢氧化钠反应生成碳酸钠,广口瓶中气压变小,流入瓶中的氢氧化钙与碳酸钠反应产生碳酸钙白色沉淀,此时U型管右侧气压也变小,使注射器中液体自动喷出,酚酞溶液遇碱性氢氧化钙溶液变为红色.
分析 根据氢氧化钠浓溶液和二氧化碳反应,气体被消耗,瓶内压强减小解答;
根据碱溶液能使无色酚酞变红解答;根据二氧化碳与氢氧化钠反应生成的碳酸钠与氢氧化钙反应产生碳酸钙白色沉淀解答;
解答 解:氢氧化钠浓溶液和二氧化碳反应,化学方程式为:CO2+2NaOH=Na2CO3+H2O;气体被消耗,瓶内压强减小,U型管左侧的液体有部分液体沿导管进入广口瓶;由于U型管左侧的液体有部分液体沿导管进入广口瓶,导致U型管中右侧空气中压强减小,从而大气压将压注射器,造成注射器中的液体自动喷出,碱溶液能使无色酚酞变红;广口瓶中出现浑浊现象的原因二氧化碳与氢氧化钠反应生成的碳酸钠与氢氧化钙反应产生碳酸钙白色沉淀;
故答案为:【实验现象】液体自动喷出或自动喷入U型管或进入U型管;液体变红,并有部分液体沿导管进入广口瓶(有液体进入即给分)
【实验解释】CO2+2NaOH=Na2CO3+H2O
二氧化碳与氢氧化钠反应生成碳酸钠,广口瓶中气压变小,流入瓶中的氢氧化钙与碳酸钠反应产生碳酸钙白色沉淀,此时U型管右侧气压也变小,使注射器中液体自动喷出,酚酞溶液遇碱性氢氧化钙溶液变为红色.
点评 合理设计实验,科学地进行实验、分析实验,是得出正确实验结论的前提,因此要学会设计实验、进行实验、分析实验,为学好化学知识奠定基础.

练习册系列答案
相关题目
4.液氧转化为氧气的过程中,发生的变化是( )
| A. | 化学性质发生变化 | B. | 混合物变为纯净物 | ||
| C. | 分子总数增加 | D. | 分子间的间隔增大 |
8.下列图象不能正确反应其对应变化关系的是( )
| A. |  加热一定质量的高锰酸钾制取氧气 | |
| B. |  向等质量的铅粉和镁粉中分别滴入质量分数相同的足量的稀盐酸 | |
| C. |  氢气和过量的氧气在密闭容器中完全反应 | |
| D. |  向一定质量的氯化铁和稀盐酸的混合溶液中逐滴加入氢氧化钠溶液 |
18.下列说法不正确的是( )
| A. | 稀溶液也可能是饱和溶液 | |
| B. | 用汽油乳化除去试管内壁的油脂 | |
| C. | 同一种物质在不同溶剂中的溶解性不同 | |
| D. | 冬天,在汽车水箱里加入少量乙二醇可以降低水的凝固点 |
5.对于化学反应:甲+乙=丙+丁,其中甲、乙、丙、丁既可能是单质也可能是化合物.下列说法中,正确的是( )
| A. | 若甲、乙、丙、丁均是化合物,则该反应一定是复分解反应 | |
| B. | 若甲、乙、丙分别是酸、碱、盐,则丁一定是水 | |
| C. | 若甲是一氧化碳,乙是金属氧化物,则丙可能是二氧化碳 | |
| D. | 若甲是铁,丙是氢气,则乙一定是稀盐酸 |
2.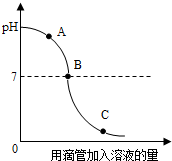 实验小组探究盐酸和氢氧化钠反应过程中溶液pH的变化规律,得到如图所示曲线.下列有关该实验事实的说法正确的是( )
实验小组探究盐酸和氢氧化钠反应过程中溶液pH的变化规律,得到如图所示曲线.下列有关该实验事实的说法正确的是( )
 实验小组探究盐酸和氢氧化钠反应过程中溶液pH的变化规律,得到如图所示曲线.下列有关该实验事实的说法正确的是( )
实验小组探究盐酸和氢氧化钠反应过程中溶液pH的变化规律,得到如图所示曲线.下列有关该实验事实的说法正确的是( )| A. | A点时溶液呈酸性 | |
| B. | B点表示盐酸和氢氧化钠恰好完全反应 | |
| C. | C点时,溶液中的溶质只有氯化钠 | |
| D. | 该实验是将氢氧化钠溶液滴入盐酸中 |

