题目内容
某研究性学习小组称取含NaCl和Na2CO3固体25.0g,将其配制成溶液,再向其中滴加足量的7.3%的稀盐酸,使气体完全放出,共收集到8.8gCO2气体.
(1)计算原固体中Na2CO3的质量分数;
(2)消耗盐酸的质量;
(3)反应后所得溶液中溶质的质量分数.
解:(1)设碳酸钠的质量为x,盐酸中溶质的质量为y,生成氯化钠的质量为z
Na2CO3+2HCl=2NaCl+H2O+CO2↑
106 73 117 44
x y z 8.8g
解之得:x=21.2g,y=14.6g,z=23.4g
(1)21.2g÷25g×100%=84.8%
(2)14.6g÷7.3%=200g
(3) ×100%=12.6%
×100%=12.6%
答:原固体中碳酸钠的质量分数为84.8%,消耗盐酸的质量为200g,反应后所得溶液中溶质的质量分数为12.6%
分析:(1)可根据二氧化碳的质量求出碳酸钠的质量,再根据 ×100%求出原固体中碳酸钠的质量分数.
×100%求出原固体中碳酸钠的质量分数.
(2)根据二氧化碳的质量求出盐酸溶液中溶质的质量,再根据溶质的质量÷盐酸溶液中溶质的质量分数求出盐酸的总质量.
(3)完全反应后所得溶液为氯化钠溶液,此溶液中溶质氯化钠既有原混合物中的氯化钠又有反应生成的氯化钠,完全反应后所得固体混合物的质量+稀盐酸的质量-放出气体二氧化碳的质量;再根据溶质的质量分数═ ×100%求得.
×100%求得.
点评:题难度较大,主要考查了根据化学方程式进行计算和有关溶液中溶质质量分数的计算,从而培养学生对概念的应用和分析问题、解决问题的能力.
Na2CO3+2HCl=2NaCl+H2O+CO2↑
106 73 117 44
x y z 8.8g
解之得:x=21.2g,y=14.6g,z=23.4g
(1)21.2g÷25g×100%=84.8%
(2)14.6g÷7.3%=200g
(3)
 ×100%=12.6%
×100%=12.6%答:原固体中碳酸钠的质量分数为84.8%,消耗盐酸的质量为200g,反应后所得溶液中溶质的质量分数为12.6%
分析:(1)可根据二氧化碳的质量求出碳酸钠的质量,再根据
 ×100%求出原固体中碳酸钠的质量分数.
×100%求出原固体中碳酸钠的质量分数.(2)根据二氧化碳的质量求出盐酸溶液中溶质的质量,再根据溶质的质量÷盐酸溶液中溶质的质量分数求出盐酸的总质量.
(3)完全反应后所得溶液为氯化钠溶液,此溶液中溶质氯化钠既有原混合物中的氯化钠又有反应生成的氯化钠,完全反应后所得固体混合物的质量+稀盐酸的质量-放出气体二氧化碳的质量;再根据溶质的质量分数═
 ×100%求得.
×100%求得.点评:题难度较大,主要考查了根据化学方程式进行计算和有关溶液中溶质质量分数的计算,从而培养学生对概念的应用和分析问题、解决问题的能力.

练习册系列答案
相关题目
为了测定黄铜(铜、锌合金)的组成,某研究性学习小组称取该样品10g放入烧杯中,将80g9.8%的稀硫酸分四次加入该烧杯中,充分反应后,测得剩余固体质量数据记录如下:
试计算:
(1)样品中铜的质量分数是 ;
(2)反应所消耗的硫酸溶液质量;
(3)第三次加入硫酸充分反应后,所得溶液中溶质的质量分数是 .
| 次数 | 1 | 2 | 3 | 4 |
| 加入稀硫酸的质量/g | 20.0 | 20.0 | 20.0 | 20.0 |
| 剩余固体的质量/g | 8.7 | 7.4 | 6.1 | 5.8 |
(1)样品中铜的质量分数是
(2)反应所消耗的硫酸溶液质量;
(3)第三次加入硫酸充分反应后,所得溶液中溶质的质量分数是
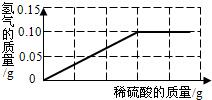 为了测定黄铜(铜、锌合金)的组成,某研究性学习小组称取该样品10g,向其中逐滴加入9.8%的稀硫酸,反应过程中生成的气体与所用硫酸溶液的质量关系如图所示.试计算:
为了测定黄铜(铜、锌合金)的组成,某研究性学习小组称取该样品10g,向其中逐滴加入9.8%的稀硫酸,反应过程中生成的气体与所用硫酸溶液的质量关系如图所示.试计算: A、B两种固体物质的溶解度曲线如图所示.请完成下列问题:
A、B两种固体物质的溶解度曲线如图所示.请完成下列问题: