题目内容
3.下列鉴别方法能把待鉴别的物质区分开的是( )| 待鉴别的物质 | 鉴别方法 | |
| A | 澄清石灰水和氢氧化钠溶液 | 加盐酸,观察现象 |
| B | 硬水和软水 | 加肥皂水,振荡,观察产生泡沫情况 |
| C | 过氧化氢溶液和纯水 | 加硫酸铜溶液,观察有无气泡产生 |
| D | 羊毛线和涤纶线 | 灼烧,闻气味 |
分析 鉴别物质时,首先对需要鉴别的物质的性质进行对比分析找出特性,再根据性质的不同,选择适当的试剂,出现不同的现象的才能鉴别.
解答 解:A、盐酸与氢氧化钙反应生成易溶于水的氯化钙和水,没有现象;盐酸与氢氧化钠反应生成易溶于水的氯化钠和水,没有现象,现象相同,无法鉴别;
B、取样品,滴加肥皂水振荡,泡沫多的是软水,泡沫少的是硬水,现象不同,可以鉴别;
C、过氧化氢加硫酸铜能迅速产生氧气,而水不能,现象不同,可以鉴别;
D、羊毛线灼烧有烧焦羽毛的气味,而涤纶线灼烧没有烧焦羽毛的气味,现象不同,因此可以用灼烧法鉴别;
故答案为:BC;灼烧,闻气味.
点评 本题考查了常见物质的鉴别,在解此类题时,首先分析被鉴别物质的性质,然后选择适当的试剂和方法,出现不同的现象即可鉴别.

练习册系列答案
相关题目
14. 如图所示为金属腐蚀的探究实验中部分装置图.由图A可知,铁生锈的主要条件是与( )直接接触.
如图所示为金属腐蚀的探究实验中部分装置图.由图A可知,铁生锈的主要条件是与( )直接接触.
 如图所示为金属腐蚀的探究实验中部分装置图.由图A可知,铁生锈的主要条件是与( )直接接触.
如图所示为金属腐蚀的探究实验中部分装置图.由图A可知,铁生锈的主要条件是与( )直接接触.| A. | 氧气 | B. | 氧气和水 | C. | 水 | D. | 水和食盐 |
18.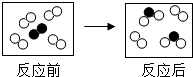 如图所示是某反应前后的微观示意图,“○”和“●”表示两种不同的原子.下列说法正确的是( )
如图所示是某反应前后的微观示意图,“○”和“●”表示两种不同的原子.下列说法正确的是( )
 如图所示是某反应前后的微观示意图,“○”和“●”表示两种不同的原子.下列说法正确的是( )
如图所示是某反应前后的微观示意图,“○”和“●”表示两种不同的原子.下列说法正确的是( )| A. | 有单质生成 | B. | 是化合反应 | ||
| C. | 参加反应的两种分子个数比为4:1 | D. | 反应前后元素的化合价没有变 |
8.我国大部分地区深受酸雨的危害,煤燃烧产生的SO2是形成酸雨的主要污染物,SO2与水结合生成弱酸性亚硫酸(H2SO3).
已知:H2SO3易分解生成水和SO2,也易与空气中的氧气或稀硝酸反应生成H2SO4;H2SO3和SO2都能使红色的品红溶液褪色.
(1)酸雨是pH小于5.6的降雨.
(2)常用脱硫方法减少废气中的SO2和O2化合生成CaSO4,化学方程式为2CaO+2SO2+O2$\frac{\underline{\;高温\;}}{\;}$2CaSO4.
(3)实验室常用亚硫酸盐与HCl或H2SO4反应制备SO2,Na2SO3与盐酸反应的化学方程式为Na2SO3+2HCl═2NaCl+H2O+SO2↑.
(4)小鸿同学利用中和反应的原理,在空气中放置一段时间的酸雨(pH约为3)中加入足量的KOH,并就反应后混合溶液中盐的成分进行如下探究:
【提出猜想】反应后的混合溶液中盐的成分是什么?
猜想1:只有K2SO4
猜想2:只有K2SO3
猜想3:既有K2SO4,也有K2SO3
【实验探究】限选试剂:稀硫酸、稀盐酸、稀硝酸氯化钡溶液、澄清石灰水、红色品红溶液、紫色石蕊溶液.
已知:H2SO3易分解生成水和SO2,也易与空气中的氧气或稀硝酸反应生成H2SO4;H2SO3和SO2都能使红色的品红溶液褪色.
(1)酸雨是pH小于5.6的降雨.
(2)常用脱硫方法减少废气中的SO2和O2化合生成CaSO4,化学方程式为2CaO+2SO2+O2$\frac{\underline{\;高温\;}}{\;}$2CaSO4.
(3)实验室常用亚硫酸盐与HCl或H2SO4反应制备SO2,Na2SO3与盐酸反应的化学方程式为Na2SO3+2HCl═2NaCl+H2O+SO2↑.
(4)小鸿同学利用中和反应的原理,在空气中放置一段时间的酸雨(pH约为3)中加入足量的KOH,并就反应后混合溶液中盐的成分进行如下探究:
【提出猜想】反应后的混合溶液中盐的成分是什么?
猜想1:只有K2SO4
猜想2:只有K2SO3
猜想3:既有K2SO4,也有K2SO3
【实验探究】限选试剂:稀硫酸、稀盐酸、稀硝酸氯化钡溶液、澄清石灰水、红色品红溶液、紫色石蕊溶液.
| 步骤 | 实验操作 | 预期现象与结论 |
| 1 | 各取2mL反应后混合溶液分别加入A、B两支试管中 | / |
| 2 | 向A试管中滴加足量稀硫酸,随即滴加几滴红色品红溶液. | 有气泡产生,品红溶液褪色, 证明含有K2SO3. |
| 3 | 向B试管中,加入足量的氯化钡溶液,再加入足量稀盐酸. | 先有白色沉淀产生,后有气泡产生,沉淀部分溶解,证明含有K2SO4,则猜想3成立. |
 乙醚是人类很早就使用的有机麻醉剂,分子结构如图所示,其中短线表示原子间的连接(例如水分子的结构可表示为H-O-H).根据乙醚的结构式回答有关问题;
乙醚是人类很早就使用的有机麻醉剂,分子结构如图所示,其中短线表示原子间的连接(例如水分子的结构可表示为H-O-H).根据乙醚的结构式回答有关问题;