题目内容
20.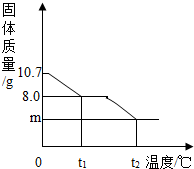 胆矾晶体部分失水后得到某硫酸铜晶体(CuSO4•xH2O),华雪同学为研究CuSO4•xH2O加热后所得物质的组成,做了以下实验:取10.7gCuSO4•xH2O晶体加热使其分解,绘制出固体的质量随温度的变化关系图.(资料:CuSO4•x H2O的相对分子质量为:160+18x)
胆矾晶体部分失水后得到某硫酸铜晶体(CuSO4•xH2O),华雪同学为研究CuSO4•xH2O加热后所得物质的组成,做了以下实验:取10.7gCuSO4•xH2O晶体加热使其分解,绘制出固体的质量随温度的变化关系图.(资料:CuSO4•x H2O的相对分子质量为:160+18x)如图所示,到t1℃时该固体完全失去结晶水,(化学方程式为:CuSO4•xH2O $\frac{\underline{\;\;△\;\;}}{\;}$ CuSO4+xH2O↑)
(1)计算该硫酸铜晶体(CuSO4•xH2O)中x的值.
(2)硫酸铜晶体中铜元素的质量分数是多少?(准确到0.1%)
(3)升温到t2℃,残留固体是黑色物质,则黑色固体是CuO.
分析 (1)根据胆矾晶体受热分解的化学方程式和胆矾与结晶水的质量,列出比例式,就可计算出胆矾晶体中x的值;
(2)根据计算出的x确定硫酸铜晶体和化学式,再求出铜元素的质量分数;
(3)因为升温到t2℃时是硫酸铜受热继续分解,根据质量守恒定律,生成物质中一定有Cu,预测黑色物质.
解答 解:(1)通过分析题意和图象中的数据可知,
CuSO4•xH2O$\frac{\underline{\;\;△\;\;}}{\;}$CuSO4+xH2O↑
160 18x
8.0g (10.7-8.0)g
$\frac{160}{8g}$=$\frac{18x}{10.7g-8g}$
x=3
(2)所以硫酸铜晶体的化学式为CuSO4•3H2O,铜元素的质量分数为:$\frac{64}{64+32+64+54}$×100%=29.9%;
(3)根据原子守恒,黑色物质中一定含有铜,化学式CuO.
故答案为:(1)3;
(2)29.9%;
(3)CuO.
点评 本题主要考查学生运用所学化学知识综合分析和解决实际问题的能力.增加了学生分析问题的思维跨度,强调了学生整合知识的能力

练习册系列答案
相关题目
10.括号内是区分下列各组物质的试剂或方法,其中不恰当的是( )
| A. | 氢氧化钠溶液和氢氧化钙溶液(CO2) | B. | 氮气与稀有气体(燃着的木条) | ||
| C. | 聚乙烯与聚氯乙烯(灼烧) | D. | 丝绸与棉布(灼烧) |
8.下列实验现象描述正确的是( )
| A. | 铁丝在氧气中剧烈燃烧,发出白光 | |
| B. | 打开浓硫酸的试剂瓶盖,瓶口会出现白雾 | |
| C. | 在电解水实验中,电源的正负极产生气体的体积比为2:1 | |
| D. | 空气中氧气体积分数测定实验结束后,进入集气瓶中水的体积约为集气瓶中气体体积的$\frac{1}{5}$ |

 甲、乙、丙、丁、戊均为初中化学常见物质.如图反映了它们之间的相互关系,其中“-”表示相连的物质间可以相互反应,“→”表示甲在一定条件下可以转化为戊.(反应条件、其他生成物已略去)请回答:
甲、乙、丙、丁、戊均为初中化学常见物质.如图反映了它们之间的相互关系,其中“-”表示相连的物质间可以相互反应,“→”表示甲在一定条件下可以转化为戊.(反应条件、其他生成物已略去)请回答: