题目内容
10.我们学习过常见气体的实验室制法,知道了制取气体的一般思路和方法.(1)实验室制取气体时,确定发生装置需要考虑的两种因素有AC(填字母);
A.反应物的状态
B.气体的密度
C.反应的条件
D.气体的溶解性
(2)某实验室的仪器柜里有如图仪器:

仪器①的名称是长颈漏斗;实验室用大理石和稀盐酸制备并收集二氧化碳时,不可能选择的仪器是②(填序号);
(3)请写出实验室用大理石和稀盐酸制备二氧化碳的化学反应方程式:CaCO3+2HCl=CaCl2+H2O+CO2↑.
分析 (1)在实验室制取气体,“制取”包括发生装置和收集装置;发生装置的选定与反应物的状态和反应条件有关,据此进行分析解答.
(2)根据常见的化学仪器的名称,根据实验室中制取二氧化碳的反应原理和反应条件来选择反应的发生装置,根据二氧化碳的密度及水溶性来选择收集装置,进行分析解答.
(3)碳酸钙与稀盐酸反应生成氯化钙、水和二氧化碳,写出反应的化学方程式即可.
解答 解:(1)因为发生装置的选定与反应物的状态和反应条件有关.如反应物是固体+液体反应,不需加热,属于固液常温型制取气体;反应物都是固体,且需要加热,属于固体加热型,需要选用有酒精灯等加热装置的装置.故确定某种气体的发生装置时,需要考虑的因素是反应物的状态和反应条件.
(2)仪器①是长颈漏斗.
实验室中制取二氧化碳常用大理石和稀盐酸反应来制取,属于固液常温型;二氧化碳密度比空气大,能溶于水,所以应用向上排空气法来收集二氧化碳.可能选择的仪器是①③④⑤;不需要进行加热,不可能选择的仪器是②.
(3)碳酸钙与稀盐酸反应生成氯化钙、水和二氧化碳,反应的化学方程式是:CaCO3+2HCl=CaCl2+H2O+CO2↑.
故答案为:(1)AC;(2)长颈漏斗;②;(3)CaCO3+2HCl=CaCl2+H2O+CO2↑.
点评 本题难度不大,是中考的重要考点之一,熟练掌握实验室中制取二氧化碳气体的反应原理、发生装置和收集装置的选择依据等是正确解答本题的关键.

练习册系列答案
 活力课时同步练习册系列答案
活力课时同步练习册系列答案 学业测评一课一测系列答案
学业测评一课一测系列答案
相关题目
18.实验是科学探究的重要方法,如图是测定空气中氧气含量实验的两套装置图,请结合图示回答有关问题.
(1)根据如表提供的实验数据,完成如表.
(2)装置一和装置二中气球的位置不同,装置二(填“装置一”或“装置二”)更合理,理由是能让空气更易流通,全部通过铜粉,使氧气与铜粉充分反应.
(3)若实验测得的结果偏小(氧气的体积分数小于21%),可能的原因有哪些?(列举两条)铜粉的量不足、未待装置完全冷却至室温就读数.

(1)根据如表提供的实验数据,完成如表.
| 硬质玻璃管中空气的体积 | 反应前注射器中空气体积 | 反应后注射器中气体体积 | 实验测得空气中氧气的体积分数 |
| 25mL | 15mL | 9mL |
(3)若实验测得的结果偏小(氧气的体积分数小于21%),可能的原因有哪些?(列举两条)铜粉的量不足、未待装置完全冷却至室温就读数.
5.下列关于二氧化碳的说法错误的是( )
| A. | 二氧化碳可用于制碳酸类饮料 | B. | 干冰(固体二氧化碳)可用于人工降雨 | ||
| C. | 二氧化碳是引发酸雨的“罪魁” | D. | “低碳”是指较少的CO2排放 |
15. 如图,表示在一定条件下发生的某化学反应,则下列说法正确的是( )
如图,表示在一定条件下发生的某化学反应,则下列说法正确的是( )
 如图,表示在一定条件下发生的某化学反应,则下列说法正确的是( )
如图,表示在一定条件下发生的某化学反应,则下列说法正确的是( )| A. | 两种反应物均为化合物 | B. | 该反应不符合质量守恒定律 | ||
| C. | 该反应前后元素的种类发生了改变 | D. | 该反应属于化合反应 |
2.下列物质盼名称、俗名、化学式及类别中,完全对应的是( )
| 物质的名称 | 俗名 | 化学式 | 类别 | |
| A | 氯化钠 | 食盐 | NaCl2 | 盐 |
| B | 碳酸氢钠 | 纯碱 | NaHCO3 | 酸 |
| C | 氢氧化钙 | 熟石灰 | CaO | 金属氧化物 |
| D | 氢氧化钠 | 火碱 | NaOH | 碱 |
| A. | A | B. | B | C. | C | D. | D |
20.已知下列反应能够发生:①Cu+4HNO3(浓)=Cu(NO3)2+2NO2↑+2H2O;②Cu+2H2SO4(浓) $\frac{\underline{\;\;△\;\;}}{\;}$ CuSO4+SO2↑+2H2O;③Cu+Cl2$\frac{\underline{\;\;△\;\;}}{\;}$CuCl2.其中NO2、SO2、Cl2都是有毒气体,请选择用铜制取CuSO4•5H2O晶体最合理的方案是( )
| A. | Cu+Cl2→CuCl2$\stackrel{NaOH}{→}$Cu(OH)2$\stackrel{H_{2}SO_{4}}{→}$CuSO4溶液→蒸发浓缩→冷却结晶→过滤 | |
| B. | Cu+HNO3(浓)→Cu(NO3)2 $\stackrel{NaOH}{→}$Cu(OH)2$\stackrel{浓H_{2}SO_{4}}{→}$CuSO4浓溶液→冷却结晶→过滤 | |
| C. | Cu+O2→CuO$\stackrel{H_{2}SO_{4}}{→}$ CuSO4溶液→蒸发浓缩→冷却结晶→过滤洗涤 | |
| D. | Cu+H2SO4(浓)→CuSO4浓溶液→冷却结晶→过滤洗涤 |
 水是我们生活中重要物质.请用学过的知识回答下列有关水的问题:
水是我们生活中重要物质.请用学过的知识回答下列有关水的问题: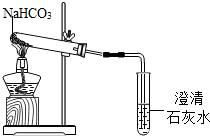 碳酸氢钠是一种重要的盐类物质,在生活中用途广泛.小红同学设计实验对碳酸氢钠的性质进行了探究.请你参与她的探究活动.
碳酸氢钠是一种重要的盐类物质,在生活中用途广泛.小红同学设计实验对碳酸氢钠的性质进行了探究.请你参与她的探究活动.