题目内容
12.将40克质量分数为10%的氢氧化钡溶液与20克质量分数为20%的盐酸溶液混合后,再加入下列物质:①AgNO3 ②Ba(NO3)2 ③NaOH ④Na2SO4,一定能发生反应的是( )| A. | ①②③ | B. | ①②④ | C. | ②③④ | D. | ①③④ |
分析 根据氢氧化钡与稀盐酸反应的化学方程式,判断完全反应后剩余的是哪一种溶液,结合酸或碱的化学性质,进行分析判断.
解答 解:40克质量分数为10%的氢氧化钡溶液中含有氢氧化钡的质量为40g×10%=4g;20克质量分数为20%的盐酸溶液中含有氯化氢的质量为20g×20%=4g.
反应中消耗盐酸酸与氢氧化钠的质量比关系如下:
Ba(OH)2+2HCl═BaCl2+2H2O
171 73
可知,171份质量的盐酸与73份质量的氢氧化钠恰好完全反应,则将40克质量分数为10%的氢氧化钡溶液与20克质量分数为20%的盐酸溶液混合后,稀盐酸有剩余,所得溶液是氯化钡和盐酸的混合溶液.
①氯化钡、盐酸均能与AgNO3反应生成氯化银沉淀.
②氯化钡、盐酸不与硝酸钡溶液反应.
③盐酸能与氢氧化钠溶液发生中和反应.
④氯化钡与硫酸钠溶液反应生成硫酸钡沉淀和氯化钠.
故①③④一定能发生反应.
故选:D.
点评 本题难度不大,掌握中和反应应用,根据化学方程式的计算判断出反应后剩余的物质是正确解答本题的关键.

练习册系列答案
 期末冲刺100分创新金卷完全试卷系列答案
期末冲刺100分创新金卷完全试卷系列答案
相关题目
2.中和反应在生活生产中有广泛的应用.下列做法利用中和反应原理的是( )
| A. | 用盐酸除去铁锈 | B. | 用氨水(NH3•H2O)处理工厂的硫酸 | ||
| C. | 用碳酸钙作补钙剂 | D. | 用含氧化镁的药物治疗胃酸过多 |
20.下列有关合金的说法错误的是( )
| A. | 铝合金是一种化合物 | B. | 生铁是一种铁的合金 | ||
| C. | 黄铜的硬度比纯铜的硬度大 | D. | 焊锡的熔点比锡的熔点低 |
17.小陈同学以“温瑞唐河水污染情况调查”为课题进行研究性学习,为了较准确地测定温瑞唐河水样品的酸碱度,可以使用( )
| A. | 紫色石蕊试液 | B. | 无色酚酞试液 | C. | pH试纸 | D. | 蓝色石蕊试液 |
4.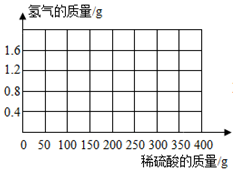 为了测定某种黄铜(铜和锌的合金)的组成,现取该黄铜样品碎屑100g,把400g稀硫酸分4次加入到该样品中,测得数据记录如下表:(Zn+H2SO4═H2↑+ZnSO4)
为了测定某种黄铜(铜和锌的合金)的组成,现取该黄铜样品碎屑100g,把400g稀硫酸分4次加入到该样品中,测得数据记录如下表:(Zn+H2SO4═H2↑+ZnSO4)
(1)第2次测得剩余固体质量为74g,其成分中含铜、锌物质.
(2)该黄铜样品中铜和锌的质量比是27:13.
(3)计算所用稀硫酸的溶质质量分数,并画出反应生成的氢气质量与加入稀硫酸质量的关系图.
 为了测定某种黄铜(铜和锌的合金)的组成,现取该黄铜样品碎屑100g,把400g稀硫酸分4次加入到该样品中,测得数据记录如下表:(Zn+H2SO4═H2↑+ZnSO4)
为了测定某种黄铜(铜和锌的合金)的组成,现取该黄铜样品碎屑100g,把400g稀硫酸分4次加入到该样品中,测得数据记录如下表:(Zn+H2SO4═H2↑+ZnSO4)| 第1次 | 第2次 | 第3次 | 第4次 | |
| 加人稀硫酸质量(g) | 100 | 100 | 100 | 100 |
| 剩余固体质量(g) | 87 | 74 | 67.5 | 67.5 |
(2)该黄铜样品中铜和锌的质量比是27:13.
(3)计算所用稀硫酸的溶质质量分数,并画出反应生成的氢气质量与加入稀硫酸质量的关系图.
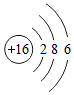 ;(4)4个氢原子4H;
;(4)4个氢原子4H;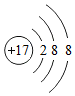 表示的是Cl-;(10)地壳中含量最多的金属元素Al.
表示的是Cl-;(10)地壳中含量最多的金属元素Al.
