题目内容
15.在AgNO3、Zn(NO3)2的混合溶液中加入一定量的铁粉,充分反应后过滤.向滤渣中加入稀盐酸,有气泡产生.根据上述现象,下列结论正确的是( )| A. | 滤渣中一定有Zn | B. | 滤渣中可能有Ag、Cu | ||
| C. | 滤液中-定有Fe(NO3)2、Zn(NO3)2 | D. | 滤液中可能有AgNO3、Cu(NO3)2 |
分析 在金属活动性顺序中,氢前的金属能与酸反应生成氢气,位置在前的金属能将位于其后的金属从其盐溶液中置换出来,利用此知识分析即可.
解答 解:在金属活动性顺序中,锌>铁>氢>银,在AgNO3、Zn(NO3)2的混合溶液中加人一定量的铁粉,铁能置换出硝酸银中的银,不能置换硝酸锌中的锌,充分反应后过滤,向滤渣中加入稀盐酸有气泡产生,说明加入的铁是过量的,所以滤渣中一定含有的物质是银、铁,溶液中-定有Fe(NO3)2、Zn(NO3)2.
A、由于锌的活动性大于铁,滤渣中一定没有Zn,故A错误;
B、滤渣中不可能有Cu,故B错误;
C、由上述分析可知,滤液中-定有Fe(NO3)2、Zn(NO3)2,故C正确;
D、滤液中不可能有Cu(NO3)2,故D错误.
故选C.
点评 此题考查了金属活动顺序表中锌、铁、铜、银的金属活动性强弱,及其金属活动性顺序表的应用,锻炼了学生分析问题解决问题的能力.

练习册系列答案
相关题目
5.某兴趣小组利用家中的材料设计实验研究影响物质溶解性(一种物质溶解在另一种物质中的能力)的因素,实验步骤如下.
Ⅰ.称取一定质量的食盐,研磨成粉末,并按照每份3.6g将产品分成若干份备用.
Ⅱ.按照表进行实验并记录实验结果(实验所需仪器略去)
请回答下列问题:
(1)表格中a为10g,b为水.
(2)根基上述的设计,你认为他们准备研究的影响因素有4种,根据常识可知其中不会影响物质溶解性的因素是溶质的状态.
(3)多组实验中使用研磨好的粉末状的实验或硝酸钾而不使用块状物的优点是粉末状比块状的溶解速度快,节约实验时间.
(4)有人认为将第一组与第五组实验进行对比,不能得出准确的结论,请简述理由:只有温度不同,其余要素一致,而结果也一致,所以无法下结论.
(5)由上述实验可知,20℃时食盐的溶解性>(填“>”“<”或“=”)硝酸钾的溶解性.
Ⅰ.称取一定质量的食盐,研磨成粉末,并按照每份3.6g将产品分成若干份备用.
Ⅱ.按照表进行实验并记录实验结果(实验所需仪器略去)
| 第一组 | 第二组 | 第三组 | 第四组 | 第五组 | |
| 实验温度 | 20℃ | 20℃ | 20℃ | 20℃ | 80℃ |
| 溶质种类 | 食盐 | 食盐 | 食盐 | 硝酸钾 | 食盐 |
| 溶质状态 | 粉末 | 粉末 | 块状 | 粉末 | 粉末 |
| 溶质质量 | 3.6g | 3.6g | 3.6g | 3.6g | 3.6g |
| 溶剂种类 | 水 | 植物油 | b | 水 | 水 |
| 溶剂质量 | 10g | a | 10g | 10g | 10g |
| 溶解情况 | 固体全溶 | 固体不溶 | 固体全溶 | 固体部分溶 | 固体全溶 |
(1)表格中a为10g,b为水.
(2)根基上述的设计,你认为他们准备研究的影响因素有4种,根据常识可知其中不会影响物质溶解性的因素是溶质的状态.
(3)多组实验中使用研磨好的粉末状的实验或硝酸钾而不使用块状物的优点是粉末状比块状的溶解速度快,节约实验时间.
(4)有人认为将第一组与第五组实验进行对比,不能得出准确的结论,请简述理由:只有温度不同,其余要素一致,而结果也一致,所以无法下结论.
(5)由上述实验可知,20℃时食盐的溶解性>(填“>”“<”或“=”)硝酸钾的溶解性.
6.向一定质量的AgNO3和Cu(NO3)2的混合溶液中加入质量为m的Zn粉,充分反应后过滤,将滤渣洗涤、干燥后称量质量,得到固体的质量为m(不计损耗).由此判断下列说法中不正确的是( )
| A. | 取反应后的滤液观察,滤液可能呈蓝色 | |
| B. | 取反应后的滤液滴加稀盐酸,有白色沉淀产生 | |
| C. | 取滤渣滴加稀硫酸,可能有气泡产生 | |
| D. | 滤渣中的物质至少有两种 |
10.在高温下,铁与水蒸气能发生反应生成一种常见的铁的氧化物和一种气体.某兴趣小组请你参与研究:铁与水蒸气反应一段时间后剩余固体物质的成分、性质及再利用.
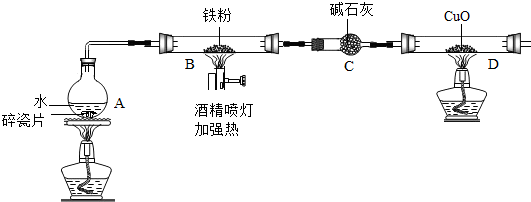
(1)【推断】观察到D中黑色固体变红,则B中生成的气体是氢气.
(2)探究B装置中剩余固体成分是什么?
【查阅资料】
1.碎瓦片能防爆沸,碱石灰是氧化钙和氢氧化钠的混合物
2.铁的氧化物中,只有Fe2O3是红棕色,其余均为黑色,只有Fe3O4能被磁铁吸引.
【初步探究】B装置中剩余固体为黑色,能全部被磁铁吸引
【猜想与假设】
猜想一:剩余固体是Fe3O4
猜想二:剩余固体是Fe与Fe3O4
【实验探究】
【实验结论】铁与水蒸气反应的化学方程式为3Fe+4H2O $\frac{\underline{\;高温\;}}{\;}$Fe3O4+4H2
(3)【成分再利用】若将B装置中剩余的黑色固体ag,经过一系列转化,全部变为红棕色固体Fe2O3(假设转化过程中铁元素无损耗),增加的质量为x,则x的取值范围为0.03a≤x<0.43a.

(1)【推断】观察到D中黑色固体变红,则B中生成的气体是氢气.
(2)探究B装置中剩余固体成分是什么?
【查阅资料】
1.碎瓦片能防爆沸,碱石灰是氧化钙和氢氧化钠的混合物
2.铁的氧化物中,只有Fe2O3是红棕色,其余均为黑色,只有Fe3O4能被磁铁吸引.
【初步探究】B装置中剩余固体为黑色,能全部被磁铁吸引
【猜想与假设】
猜想一:剩余固体是Fe3O4
猜想二:剩余固体是Fe与Fe3O4
【实验探究】
| 实验操作 | 实验现象及结论 |
(3)【成分再利用】若将B装置中剩余的黑色固体ag,经过一系列转化,全部变为红棕色固体Fe2O3(假设转化过程中铁元素无损耗),增加的质量为x,则x的取值范围为0.03a≤x<0.43a.
20.下列事实与对应的解释相符合的是( )
| A. | 空气能被压缩--分子体积可以变小 | |
| B. | 铵盐都能与氢氧化钠反应立生氨气--铵盐中含有NH4+ | |
| C. | 结冰的水不能流动--0℃以下,水分子不再运动 | |
| D. | 20mL水和20L酒精混合后的总体积小于40mL--分子的质量和体积都很小 |
4.夏天从冰箱里拿出一瓶饮料,观察到饮料外壁潮湿,说明空气中含有( )
| A. | 氧气 | B. | 氮气 | C. | 水蒸气 | D. | 二氧化碳 |
5.废物利用不仅可以保护环境,还可以节约资源,下面是某化学兴趣小组对废旧电池的回收利用,请回答下列问题.
【实验1】回收填料中的二氧化锰和氯化铵
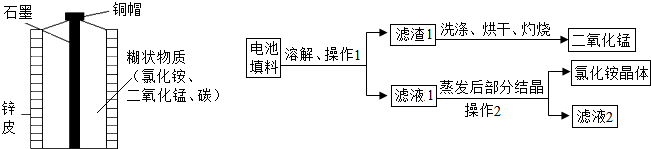
(1)操作2中玻璃棒的作用是搅拌、使液体均匀受热;
(2)灼烧滤渣1的目的是除去炭粉;
(3)在上述物质中,在实验室制取氧气的反应中可用作催化剂的是二氧化锰,含氮元素且可作氮肥的是氯化铵;
(4)在某温度下蒸发滤液 1 时,大量的氯化铵晶体析出的原因是形成了氯化铵的饱和溶液.
实验2 利用外壳回收物锌制取氢气及相关探究
(5)用锌和稀硫酸制取氢气.己知氢气密度比空气小且难溶于水.
①装置选择:选择的发生装置为B(填编号),要收集比较干燥的气体,应选用的收集装置为D(填编号).
②若用排水法收集并测定气体的体积,气体从装置 E导管口b(填“a”或“b”) 进;选用仪器 F 测量排出水的体积,仪器 F 名称是量筒,若选用50ml的量筒,收集完毕量筒中剩余4ml,则收集的气体为46mL.
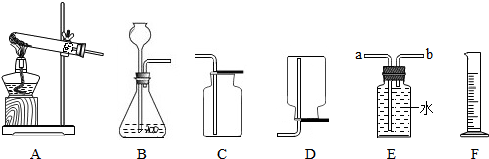
(6)探究影响锌与稀硫酸反应快慢的因素.如表是小明分别用相同质量的锌和足量的稀硫酸反应的四组实验数据:
①比较实验Ⅰ和实验Ⅱ,可以得到的结论是含杂质的锌与稀硫酸反应的快.
②为了研究硫酸浓度对反应快慢的影响,需比较实验Ⅱ和实验Ⅲ(填编号).
③实验Ⅲ和Ⅳ标明该反应快慢与温度有关;
④如果把实验Ⅱ中硫酸的质量分数改为4%,请你推测锌消失的时间(用t表示)的取值范围200~300
⑤该实验除了用锌消失的时间来衡量反应的快慢外,你还能提出新的方法来衡量该反应的快慢吗?相同的时间内产生的氢气的体积来衡量该反应的快慢.
【实验1】回收填料中的二氧化锰和氯化铵

(1)操作2中玻璃棒的作用是搅拌、使液体均匀受热;
(2)灼烧滤渣1的目的是除去炭粉;
(3)在上述物质中,在实验室制取氧气的反应中可用作催化剂的是二氧化锰,含氮元素且可作氮肥的是氯化铵;
(4)在某温度下蒸发滤液 1 时,大量的氯化铵晶体析出的原因是形成了氯化铵的饱和溶液.
实验2 利用外壳回收物锌制取氢气及相关探究
(5)用锌和稀硫酸制取氢气.己知氢气密度比空气小且难溶于水.
①装置选择:选择的发生装置为B(填编号),要收集比较干燥的气体,应选用的收集装置为D(填编号).
②若用排水法收集并测定气体的体积,气体从装置 E导管口b(填“a”或“b”) 进;选用仪器 F 测量排出水的体积,仪器 F 名称是量筒,若选用50ml的量筒,收集完毕量筒中剩余4ml,则收集的气体为46mL.

(6)探究影响锌与稀硫酸反应快慢的因素.如表是小明分别用相同质量的锌和足量的稀硫酸反应的四组实验数据:
| 实验序号 | 不同纯度的锌 | 硫酸的质量分数/% | 反应温度/℃ | 锌消失的时间/s |
| Ⅰ | 含杂质锌 | 3 | 20 | 200 |
| Ⅱ | 纯锌 | 3 | 20 | 500 |
| Ⅲ | 纯锌 | 6 | 20 | 300 |
| Ⅳ | 纯锌 | 6 | 30 | 80 |
②为了研究硫酸浓度对反应快慢的影响,需比较实验Ⅱ和实验Ⅲ(填编号).
③实验Ⅲ和Ⅳ标明该反应快慢与温度有关;
④如果把实验Ⅱ中硫酸的质量分数改为4%,请你推测锌消失的时间(用t表示)的取值范围200~300
⑤该实验除了用锌消失的时间来衡量反应的快慢外,你还能提出新的方法来衡量该反应的快慢吗?相同的时间内产生的氢气的体积来衡量该反应的快慢.
 (1)2016年底,沪昆高铁和云贵高铁即将开通,人们的出行将更加方便、快捷.结合所学化学知识,回答下列问题:
(1)2016年底,沪昆高铁和云贵高铁即将开通,人们的出行将更加方便、快捷.结合所学化学知识,回答下列问题: