题目内容
17. 如图是实验室所用盐酸试剂瓶上标签的部分内容.请仔细阅读后计算:
如图是实验室所用盐酸试剂瓶上标签的部分内容.请仔细阅读后计算:(1)欲配制14.6%的稀盐酸100g,需用这种盐酸多少毫升?(结果精确到0.1)
(2)将足量的金属铁放入所配制的溶液中,理论上可制得氢气多少克?
分析 (1)欲正确解答本题,需根据溶质质量不变和溶质质量分数公式列出方程式,进而求出需用盐酸的体积.
(2)由铁的质量根据铁与盐酸反应的化学方程式可以计算出生成氢气的质量.
解答 解:(1)设需用这种盐酸的体积为x,则
100g×14.6%=x×1.18g/cm3×36%
解得x=34.4cm3=34.4mL.
(2)设生成氢气的质量是y,
Fe+2HCl=FeCl2+H2↑
73 2
100g×14.6% y
$\frac{73}{2}=\frac{100g×14.6%}{y}$
y=0.4g
答:(1)配制14.6%的稀盐酸100g,需用这种盐酸34.4毫升;
(2)将足量的金属铁放入所配制的溶液中,理论上可制得氢气0.4克.
点评 本题考查了溶质质量分数以及根据化学方程式的有关计算,完成此题,可以依据溶质质量分数公式以及化学方程式计算.

练习册系列答案
 小学生10分钟口算测试100分系列答案
小学生10分钟口算测试100分系列答案
相关题目
8.化学与生活密切相关.生活中的下列做法不合理的是( )
| A. | 煤炉上放一盆水,就能防止一氧化碳中毒 | |
| B. | 冰箱中的异味,可用活性炭除去 | |
| C. | 电器着火,应先切断电源再灭火 | |
| D. | 生活中可用加热煮沸的方法降低水的硬度 |
12.甲、乙、丙三个集气瓶中,分别盛有氧气、空气、氮气中的一种,用一根燃着的木条分别插入瓶中,依次观察到火焰熄灭、继续燃烧、火更旺的是( )
| A. | 氮气、空气、氧气 | B. | 空气、氮气、氧气 | C. | 氮气、氧气、空气 | D. | 氧气、氮气、空气 |
13.下列物质中前者是纯净物,后者是混合物的是( )
| A. | 液氧、矿泉水 | B. | 冰水混合物、二氧化碳 | ||
| C. | 高锰酸钾、硫粉 | D. | 海水、洁净的空气 |

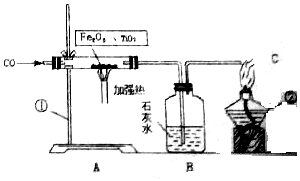 科学家发现月球的沙土中含有丰富的含氧钛铁矿.若成分为TiO2、Fe2O3的混合物.现用CO进行还原提炼单质钛和铁.实验装置如图所示.按下列要求进行回答:
科学家发现月球的沙土中含有丰富的含氧钛铁矿.若成分为TiO2、Fe2O3的混合物.现用CO进行还原提炼单质钛和铁.实验装置如图所示.按下列要求进行回答: