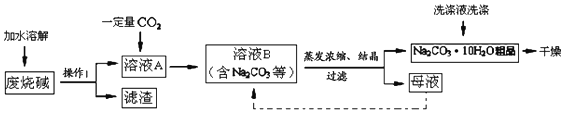
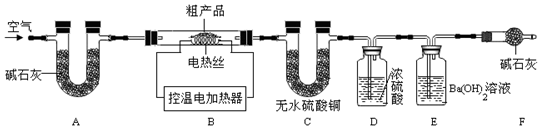
题目内容
1. 向一定量盐酸和CuCl2溶液的混合物中逐滴加入NaOH溶液,产生沉淀的质量与加入NaOH溶液的质量关系如图所示.下列说法正确的是( )
向一定量盐酸和CuCl2溶液的混合物中逐滴加入NaOH溶液,产生沉淀的质量与加入NaOH溶液的质量关系如图所示.下列说法正确的是( )| A. | P点表示的溶液pH=7 | |
| B. | MN段表示CuCl2与NaOH反应 | |
| C. | 从M点到N点溶液质量增加20 g | |
| D. | P点表示的溶液比N点表示的溶液中氯化钠的质量分数大 |
分析 向一定量盐酸和CuCl2溶液的混合物中逐滴加入NaOH溶液时,氢氧化钠先和稀盐酸反应生成氯化钠和水,后和氯化铜反应生成氢氧化铜沉淀和氯化钠.
解答 解:A、P点时氢氧化钠溶液过量,表示的溶液pH大于7,该选项说法不正确;
B、MN段表示CuCl2与NaOH反应,该选项说法正确;
C、从M点到N点,氢氧化钠和氯化铜反应生成氢氧化铜沉淀和氯化钠,加入氢氧化钠溶液质量是20g,由于生成了沉淀,因此溶液增加的质量小于20g,该选项说法不正确;
D、P点和N点溶液中氯化钠质量相等,而P点溶液质量大于N点溶液质量,因此P点表示的溶液比N点表示的溶液中氯化钠的质量分数小,该选项说法不正确.
故选:B.
点评 本题主要考查物质的性质,解答时要根据各种物质的性质,结合各方面条件进行分析、判断,从而得出正确的结论.

练习册系列答案
 轻松课堂单元期中期末专题冲刺100分系列答案
轻松课堂单元期中期末专题冲刺100分系列答案
相关题目
11.将Cu-Zn合金粉末放到盛有稀硫酸的烧杯中,恰好完全反应.相关实验数据如表:
(1)生成氢气的质量为0.04g.
(2)若不考虑该合金中除Cu、Zn以外的其它成分.请计算稀硫酸的溶质质量分数.
| Cu-Zn合金的质量/g | 稀硫酸的质量/g | 反应后烧杯内物质的总质量/g |
| 4.0 | 10 | 13.96 |
(2)若不考虑该合金中除Cu、Zn以外的其它成分.请计算稀硫酸的溶质质量分数.
12.除杂是化学实验的重要环节,下列实验方法能达到实验目的是( )
| 实验目的 | 实验方法 | |
| A | 除去CO中混有的少量CO2 | 通过灼热的氧化铜粉末 |
| B | 除去O2中混有的H2O | 将气体通过氢氧化钠溶液 |
| C | 除去KCl中混有的MnO2 | 加足量水溶解,过滤,蒸发结晶 |
| D | 除去KNO3溶液中混有的K2CO3 | 加入足量稀盐酸,充分反应后,蒸发结晶 |
| A. | A、 | B. | B、 | C. | C、 | D. | D、 |
16. 有限的元素可组成种类繁多的物质.依据表中的元素回答下列问题.
有限的元素可组成种类繁多的物质.依据表中的元素回答下列问题.
(1)A溶液在黑色固体B的作用下生成无色气体D,D与生命活动息息相关.A溶液中的溶质用化学式表示为H2O2.
(2)气体单质E与红色固体F在一定条件下反应,得到固体G,反应的化学方程式为3CO+Fe2O3$\frac{\underline{\;高温\;}}{\;}$2Fe+3CO2.
(3)将一定量的固体G放入一定量且过量M溶液中,能发生反应,观察到的现象是有气泡产生,溶液由无色变为浅绿色.
(4)向(3)所得溶液中加入适量A溶液,溶液变为黄色,且溶质仅有一种,该反应的化学方程式为2FeCl2+H2O2+2HCl=3FeCl2+2H2O.
 有限的元素可组成种类繁多的物质.依据表中的元素回答下列问题.
有限的元素可组成种类繁多的物质.依据表中的元素回答下列问题.| 元素名称 | 氢 | 碳 | 氧 | 氯 | 锰 | 铁 |
| 元素符号 | H | C | O | Cl | Mn | Fe |
(2)气体单质E与红色固体F在一定条件下反应,得到固体G,反应的化学方程式为3CO+Fe2O3$\frac{\underline{\;高温\;}}{\;}$2Fe+3CO2.
(3)将一定量的固体G放入一定量且过量M溶液中,能发生反应,观察到的现象是有气泡产生,溶液由无色变为浅绿色.
(4)向(3)所得溶液中加入适量A溶液,溶液变为黄色,且溶质仅有一种,该反应的化学方程式为2FeCl2+H2O2+2HCl=3FeCl2+2H2O.
13.下列关于“一定”的说法一定正确的是( )
| A. | 电离时不出现氢氧根离子的物质一定不呈碱性 | |
| B. | 金属活动性靠前的物质一定能将靠后的物质从它的溶液中置换出来 | |
| C. | 做功的过程中,一定实现能量的转化 | |
| D. | 酵母菌一定要在无氧环境中才能存活 |
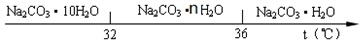

 电动剃须刀因为其方便耐用而被广泛使用,剃须刀的刀头是关键,现在比较好的剃须刀都是水洗刀头,也就是说这种剃须刀的刀头虽然是金属制造的,但是却可以用水直接冲洗.冲洗完晾干就可以了,这说明到刀头上的金属材料必须具备(1)B化学性质;
电动剃须刀因为其方便耐用而被广泛使用,剃须刀的刀头是关键,现在比较好的剃须刀都是水洗刀头,也就是说这种剃须刀的刀头虽然是金属制造的,但是却可以用水直接冲洗.冲洗完晾干就可以了,这说明到刀头上的金属材料必须具备(1)B化学性质;