题目内容
1.某校同学在学校附近采集了18g赤铁矿(主要成分为Fe2O3)样品,逐滴加入稀盐酸至恰好完全反应,共用去稀盐酸309g,过滤得到滤渣2g.(假设杂质既不溶于水,也不溶于酸;不考虑实验中的损耗),求反应后所得溶液中溶质的质量分数是多少?分析 赤铁矿与盐酸混合,铁矿中氧化铁和盐酸反应,得到氯化铁溶液,铁矿中杂质既不溶酸,也不溶于水,形成滤渣.所以,铁矿中氧化铁的质量可由18g-2g=16g.
解答 解:赤铁矿样品中Fe2O3的质量=18g-2g=16g;
设反应后生成氯化铁的质量为x
Fe2O3+6HCl=2FeCl3+3H2O
160 325
16g x
$\frac{160}{16g}=\frac{325}{x}$
解之得 x=32.5g
反应后所得溶液质量=18g+309g-2g=325g
反应后所得溶液中溶质的质量分数$\frac{32.5g}{325g}$×100%=10%
答:反应后所得溶液中溶质的质量分数为10%.
点评 反应后溶液质量可根据质量守恒进行计算:反应后溶液质量=赤铁矿质量+稀盐酸质量-滤渣质量.

练习册系列答案
 激活思维优加课堂系列答案
激活思维优加课堂系列答案 活力试卷系列答案
活力试卷系列答案
相关题目
11.某粒子的结构示意图如图所示,下列对该粒子的判断中,错误的是( )
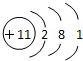
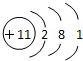
| A. | 原子核内有11个质子 | B. | 该粒子是阳离子 | ||
| C. | 在化学反应中易得电子 | D. | 该粒子属于金属元素 |
12.排放到空气中的气体污染物是( )
①二氧化碳 ②二氧化硫 ③一氧化碳 ④二氧化氮 ⑤稀有气体.
①二氧化碳 ②二氧化硫 ③一氧化碳 ④二氧化氮 ⑤稀有气体.
| A. | ①②③ | B. | ④⑤ | C. | ②③④ | D. | ②③ |
9.物质都是由微观粒子构成的,下列构成物质的微粒中,属于同种元素的是( )


| A. | ①② | B. | ①④ | C. | ②③ | D. | ③④ |
13.如图所示图标警示的是( )


| A. | 当心火灾--氧化物 | B. | 当心火灾--易燃物质 | ||
| C. | 当心爆炸--自燃物质 | D. | 当心爆炸--爆炸性物质 |