题目内容
10.碳酸镁晶须(MgCO3•nH2O,n=1~5的整数)广泛应用于冶金、耐火材料及化工产品等领域.为测定碳酸镁晶须中n的值,学习小组设计了如图1装置并进行了3次实验:(不考虑稀盐酸挥发)【查阅资料】:
a、碳酸镁晶须受热分解,生成3种氧化物;
b、相对分子质量:[Mr(MgCO3):84、Mr(H2O):18、Mr(MgO):40、Mr(CO2):44]
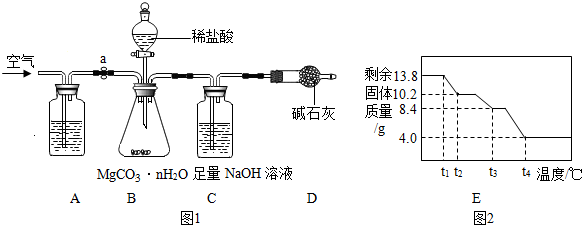
【实验步骤】
①检查装置的气密性;
②准确称取3.45g MgCO3•nH2O放在B装置中,连接仪器;
③打开弹簧夹a,鼓入一段时间空气,称量C装置的质量;
④关闭弹簧夹a,打开分液漏斗活塞,缓缓滴入稀盐酸至不再产生气体为止;
⑤打开弹簧夹a,缓缓鼓入空气;
⑥准确称量C装置的质量(如表);
| 编 号 | 1 | 2 | 3 |
| 实验前 | 228.00 | 228.00 | 228.00 |
| 实验后 | 229.10 | 229.11 | 229.09 |
⑧根据数据进行计算.
【实验分析及数据处理】
(1)完善实验步骤:①检查装置的气密性;⑤缓缓鼓入空气;
(2)请计算碳酸镁晶须中的n值.(要求有计算过程)
(3)A装置中盛放的溶液是NaOH(浓)溶液;其作用是除去空气中的CO2防止干扰实验
(4)D装置的作用是防止空气中的CO2进入C装置,造成误差;
【实验反思】
(5)下列选项中,会造成实验结果偏大的是①⑤;偏小的是②③④;
①反应结束后,没有通空气; ②称量C装置前,没有通空气;
③没有A装置; ④没有D装置;
⑤稀盐酸滴加速率太快; ⑥C装置中NaOH溶液浓度过大;
(7)为精确测定n的值,在老师指导下,小组同学称取13.8g MgCO3•nH2O进行热重分析,并绘制出如图2所示的热重曲线示意图.则:
①t1-t2段发生的反应化学方程式为:MgCO3•3H2O$\frac{\underline{\;\;△\;\;}}{\;}$MgCO3•H2O+2H2O;
②t2-t3段发生的反应化学方程式为:MgCO3•H2O$\frac{\underline{\;\;△\;\;}}{\;}$MgCO3+H2O.
③t3-t4段发生的反应化学方程式为:MgCO3$\frac{\underline{\;\;△\;\;}}{\;}$MgO+CO2↑.
分析 (1)根据实验目的分析实验步骤
(2)根据二氧化碳与碳酸镁晶体的质量关系分析
(3)根据实验目的分析氢氧化钠溶液的作用
(4)根据C装置的作用分析D装置的作用
(5)根据操作步骤引起的二氧化碳质量 的变化分析对n值的影响
(7)根据图象分析晶体分解过程及产物.
解答 解:(1)有气体生成的装置必须先检查装置的气密性.通过碳酸镁晶体与盐酸反应产生二氧化碳的质量确定n的值,实验前应将装置中的二氧化碳排净,因此先将除去二氧化碳的空气鼓入装置,要除去空气中二氧化碳,可将空气通过氢氧化钠溶液吸收,然后关闭弹簧夹a,打开分液漏斗活塞,缓缓滴入稀盐酸至不再产生气体为止,打开弹簧夹a,缓缓鼓入空气,使产生的二氧化碳全部排到C装置中,C装置增重的质量即为生成的二氧化碳的质量.
(2)3次实验C装置平均增重$\frac{(1.1+1.11+1.09)g}{3}$=1.1g
MgCO3•nH2O~CO2
84+18n 44
3.45g 1.1g
$\frac{84+18n}{3.45g}$=$\frac{44}{1.1g}$
解得:n=3
(3)由上述分析可知A装置内盛的是氢氧化钠溶液,以吸收空气中的二氧化碳,防止对生成二氧化碳质量的干扰,.
(4)D装置碱石灰的作用是防止空气中的CO2进入C装置,造成误差
(5)①反应结束后,没有通空气,产生的二氧化碳没有全部排到C装置,使二氧化碳的质量偏小,引起结果偏大
②称量C装置前,没有通空气,使空气中二氧化碳被C装置吸收,使二氧化碳的质量偏大,引起结果偏小.
③没有A装置,使空气中二氧化碳被C装置吸收,使二氧化碳的质量偏大,引起结果偏小.
④没有D装置,使外界空气中二氧化碳进入C装置吸收,使二氧化碳的质量偏大,引起结果偏小.
⑤稀盐酸滴加速率太快,产生的二氧化碳没有全部被C装置吸收,使二氧化碳的质量偏小,引起结果偏大
⑥C装置中NaOH溶液浓度过大,不会影响二氧化碳的质量,对结果没有影响.
(7)①由第(2)问计算可知该晶体的化学式为MgCO3•3H2O,由图象可知该晶体分解过程先分解生成水,当结晶水全部失去后碳酸镁分解生成氧化镁和水,设t2℃时,剩余固体化学式为MgCO3•xH2O,则此时分解的化学方程式为
MgCO3•3H2O$\frac{\underline{\;\;△\;\;}}{\;}$MgCO3•xH2O+(3-x)H2O
138 13.8g 10.2g
$\frac{138}{13.8g}$=$\frac{84+x×18}{10.2g}$
x=1
故此时物质的化学式为MgCO3•H2O
②t2-t3段发生的反应MgCO3•H2O分解为MgCO3和H2O;
③根据分解过程可知最终分解过程是碳酸镁完全分解生成氧化镁和水,因此最终固体是氧化镁,化学式为MgO
故答案为:【实验分析及数据处理】
(1)完善实验步骤:①检查装置的气密性;⑤缓缓鼓入空气;
(2)3
(3)NaOH (浓)溶液;其作用是 除去空气中的CO2 防止干扰实验
(4)D装置的作用是 防止空气中的CO2进入C装置,造成误差;
【实验反思】
(5)会造成实验结果偏大的是 ①⑤;偏小的是 ②③④;
(7)①t1-t2段发生的反应化学方程式为:MgCO3•3H2O$\frac{\underline{\;\;△\;\;}}{\;}$MgCO3•H2O+2H2O;
②t2-t3段发生的反应化学方程式为:MgCO3•H2O$\frac{\underline{\;\;△\;\;}}{\;}$MgCO3+H2O.
③t3-t4段发生的反应化学方程式为:MgCO3$\frac{\underline{\;\;△\;\;}}{\;}$MgO+CO2↑
点评 本题考查通过分析实验数据测定物质组成,要注意保证产生的二氧化碳全部被吸收,同时要排除装置内空气中的二氧化碳进入C装置.

| A. | 氧化镁 MgO2 | B. | 氧化钠 NaO | C. | 氧化铝 Al2O3 | D. | 氧化铁FeO |
| A. |  | B. |  | C. |  | D. |  |
| A. | x>y>z | B. | x>z>y | C. | z>y>x | D. | y>z>x |
(1)实验发生装置的探究学习:根据反应物的状态,小岳从下列装置中选择了D作为生装置,你认为他该选择的收集装置是E或G.

实验填程中小岳发现,试管中产生了很多泡沫,甚至有些进入导气管中.经过讨论,该小组同学认为泡沫的产生可能有很多原因:可能是试管的横截面积太小,气泡不易破裂.你认为他们的猜测还可能有反应太快、双氧水浓度太大.小岳改成了C,发现泡沫没有了,但是反应的速率很快,很难对实验进行控制.小晨建议将反应装置换成B就可以了.小晨的理由是用分液漏斗可以控制双氧水滴加的量.
(2)催化剂选择的探究学习:
通过课堂上的学习,小静了解到:MnO2、土豆块都可以做H2O2分解的催化剂,于是萌生了寻找适合催化剂的想法.通过查阅资料,小静还了解到部分盐(溶液)也能对过氧化氢的分解具有催化作用,如CuCl2、CuSO4等盐(溶液).于是小静做了以下的探究.
①请你帮助她完成实验报告:
| 实验过程 | 实验现象 | 实验结论 |
| 在一支试管中加入5ml 6%的H2O2溶液,然后滴入适量的CuCl2溶液,把带火星的木条伸入试管. | CuCl2溶液可以催化分解H2O2 |
小凯说:真正催化分解H2O2的是CuCl2溶液中的H2O:
小毅说:真正催化分解H2O2的是CuCl2浴液中的Cu2+;
小留说:真正催化分解H2O2的是CuCl2溶液中的Cl-;
你认为最不可能的是小凯同学的猜想,理由双氧水溶液中就含有水.
③同学们对余下的两个猜想,用实验进行了探究.请你仔细分析后填表:
| 实验过程 | 实验现象 | 实验结论 |
| 在一支试管中加入5ml 6%的H2O2溶液,然后滴入适量的HCl溶液,把带火星的木条伸入试管. | 无明显现象 | |
| 再向这支试管中加入少量的CuCl2或CuSO4或CuO或Cu(OH)2等,并把带火星的木条伸入试管. |
| A. | 矿泉水 | B. | 空气 | C. | 加碘盐 | D. | 浮有冰的水 |