题目内容
14. 烧杯中盛有X溶液,逐滴加入(或通入)Y物质,烧杯内液体的pH变化如图所示.则符合该变化的一组物质是( )
烧杯中盛有X溶液,逐滴加入(或通入)Y物质,烧杯内液体的pH变化如图所示.则符合该变化的一组物质是( )| X | Y | |
| A | NaOH溶液 | 稀盐酸(过量) |
| B | 稀硫酸 | 水(过量) |
| C | CaCl2 | 水(过量) |
| D | Ca(OH)2 | 水(过量) |
| A. | A | B. | B | C. | C | D. | D |
分析 当溶液的pH等于7时,呈中性.当溶液的pH大于7时,呈碱性.当溶液的pH小于7时,呈酸性;根据图象,开始时溶液的PH大于7,显碱性,最后溶液的pH接近7,然后根据个选项给出的物质结合物质间的反应进行分析即可.
解答 解:A、氢氧化钠溶液显碱性,pH大于7,当加入过量的稀盐酸时,溶液的pH逐渐减小至小于7,故A错误;
B、稀硫酸显酸性,pH小于7,所以x不是稀硫酸.故B错误;
C、氯化钙溶液显中性,pH等于7,加水pH不变,故C不正确;
D、氢氧化钙溶液显碱性,pH大于7,当加水稀释时,碱性减弱,pH接近7.故D正确.
故选D.
点评 本题结合图象及pH的变化考查了常见物质间的有关反应,掌握溶液的酸碱性和溶液pH大小之间的关系、常见物质间的反应是解题的关键.

练习册系列答案
相关题目
4.下列有关实验操作错误的是( )
| A. | 用药匙取用粉末状固体或小题粒状固体 | |
| B. | 用胶头滴管滴加少量液体 | |
| C. | 给盛有$\frac{2}{3}$体积液体的试管加热 | |
| D. | 倾倒液体时试剂瓶标签面向手心 |
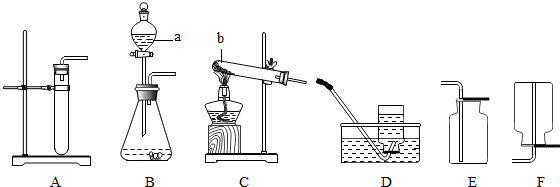
2.根据下列如图1装置图回答问题

Ⅰ.写出仪器①的名称是长颈漏斗.
Ⅱ.实验室用一定质量的氯酸钾制取氧气,通过排水量测定所收集到的氧气体积.
若各装置的连接顺序是:a→b→c→d,H装置内导管(“b”或“c”)该怎样延伸?请在图2上画出
Ⅲ.某兴趣小组为了选择实验室制取二氧化碳的原料,对影响盐酸与大理石(大理石中杂质不与盐酸反应)反应的速率快慢的因素展开研究.
提出假设:盐酸与大理石反应的速率快慢与所用HCl的质量分数、大理石颗粒大小有关.
实验设计与实施:
根据以上信息回答下列问题:
写出上述实验中反应的化学方程式CaCO3+2HCl═CaCl2+H2O+CO2↑.
实验①与②的目的是为了探究盐酸与大理石反应的速率快慢与所用HCl的质量分数的关系.
实验结论:HCl质量分数越大,反应越快;固体的颗粒越小,反应越快
根据上述实验探究,实验室选用块状大理石与稀盐酸制取二氧化碳,选用上图中具有能使反应随时发生随时停止的D(填编号)装置作为制取二氧化碳的发生装置.
Ⅳ.实验室在常温下用块状电石固体与水反应制取乙炔气体,该反应必须严格控制加水速度,以免剧烈反应引起发生装置炸裂;乙炔是一种微溶于水且密度比空气略小的气体.上图中制取较纯乙炔的最适宜发生和收集装置是CG(填编号,除装置H和I外).

Ⅰ.写出仪器①的名称是长颈漏斗.
Ⅱ.实验室用一定质量的氯酸钾制取氧气,通过排水量测定所收集到的氧气体积.
若各装置的连接顺序是:a→b→c→d,H装置内导管(“b”或“c”)该怎样延伸?请在图2上画出

Ⅲ.某兴趣小组为了选择实验室制取二氧化碳的原料,对影响盐酸与大理石(大理石中杂质不与盐酸反应)反应的速率快慢的因素展开研究.
提出假设:盐酸与大理石反应的速率快慢与所用HCl的质量分数、大理石颗粒大小有关.
实验设计与实施:
| 实验编号 | 温度 | 5克大理石(碳酸钙纯度相同)规格 | 20克盐酸的质量分数 | 完全反应所需时间/s |
| 实验① | 20℃ | 粗颗粒 | 20% | 140 |
| 实验② | 20℃ | 粗颗粒 | 10% | 220 |
| 实验③ | 20℃ | 细颗粒 | 20% | 30 |
写出上述实验中反应的化学方程式CaCO3+2HCl═CaCl2+H2O+CO2↑.
实验①与②的目的是为了探究盐酸与大理石反应的速率快慢与所用HCl的质量分数的关系.
实验结论:HCl质量分数越大,反应越快;固体的颗粒越小,反应越快
根据上述实验探究,实验室选用块状大理石与稀盐酸制取二氧化碳,选用上图中具有能使反应随时发生随时停止的D(填编号)装置作为制取二氧化碳的发生装置.
Ⅳ.实验室在常温下用块状电石固体与水反应制取乙炔气体,该反应必须严格控制加水速度,以免剧烈反应引起发生装置炸裂;乙炔是一种微溶于水且密度比空气略小的气体.上图中制取较纯乙炔的最适宜发生和收集装置是CG(填编号,除装置H和I外).
19.分类法是一种行之有效、简单易行的科学方法.小强对所学知识进行归纳,其中甲包含了乙、丙、丁….下列关系中有错误的一组是( )
| A. | 常见的空气污染物二氧化硫、一氧化碳、二氧化氮 | |
| B. | 常见的合金不锈钢、焊锡、生铁 | |
| C. | 常见的还原剂氢气、木炭、一氧化碳 | |
| D. | 常见的碱烧碱、纯碱、孰石灰 |