题目内容
14.研究和学习化学,有许多方法.下列方法中所举示例正确的是B.| 选项 | 方法 | 示例 |
| A | 实验法 | 用硫做“测定空气中氧气含量”的实验 |
| B | 归纳法 | 根据NaOH溶液、Ca(OH)2溶液等物质的化学性质,归纳出碱的通性 |
| C | 类比法 | 根据金属铁能与稀盐酸反应,推测金属铜也能与稀盐酸反应 |
| D | 分类法 | 根据组成物质的元素种类,将纯净物分为单质与化合物 |
分析 A.根据测定空气中氧气含量的方法来分析;
B.根据碱的通性来分析解答;
C.根据金属的活动性顺序来分析;
D.根据纯净物的分类来分析.
解答 解:A.硫在空气中燃烧生成二氧化硫气体,集气瓶内压强几乎不变,所以不能用硫来测定空气中氧气的含量,故错误;
B.因为NaOH和Ca(OH)2在溶液中电离出来的阴离子全部是氢氧根离子,故二者具有相似的化学性质--碱的通性,故正确;
C.在金属活动顺序中,铁排在氢的前面,能与稀盐酸反应生成氢气,而铜排在氢的后面,不能与稀盐酸反应产生氢气,故错误;
D.根据组成纯净物的元素的种类,有同一种元素组成的纯净物,属于单质,由两种或两种以上的元素组成的纯净物,属于化合物.
故答案为:B;单质与化合物.
点评 本题考查了研究和学习化学的基本方法,明确基本化学知识是解题的关键.

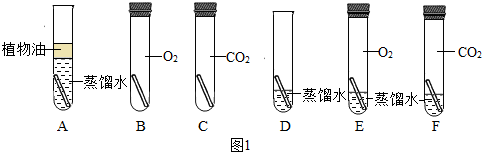
在一次用餐中,同学们对“固体酒精”产生了好奇,于是对其成分进行研究。
【查阅资料】(1)该固体酒精是用酒精、氯化钙和氢氧化钠按一定的质量比混合制成。(2)氯化钙、氯化钡溶液均呈中性。
【提出问题】(1)酒精中是否含有碳元素?
(2)固体酒精中的氢氧化钠是否变质?
【实验探究】(1)按如图实验,发现澄清石灰水变浑浊,可得出酒精中含有碳元素的结论,此结论_____(选填“合理”或“不合理”)。

(2)为确定氢氧化钠的变质程度,分组探究。取少量固体酒精于烧杯中,加足量的水充分溶解后静置。
①甲组按下表探究:
实验步骤 | 实验现象 | 结论 |
取上层清液于试管中,滴加酚酞溶液 | 溶液变红 | 清液中有氢氧化钠 |
取上层清液于另一试管中,加入适量氯化钡溶液 | _____ | 清液中有碳酸钠 |
②乙组认为甲组实验不能证明清夜中一定有氢氧化钠,理由是______________。他们另取烧杯中上层清夜,加足量氯化钡溶液,充分反应后滴加酚酞溶液,酚酞溶液变红。
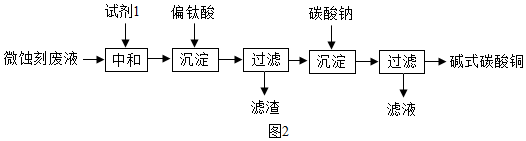
【实验结论】经讨论一致认为固体酒精中的氢氧化钠部分变质。
【拓展应用】要除去部分变质的氢氧化钠溶液中的杂质,可选择适量的___(填序号)
A.Ba(OH)2溶液 B.CaCl2溶液 C.Ca(OH)2溶液
(1)20℃时,在实验室用98%的浓硫酸配制20%的硫酸溶液:
①若要配制49g质量分数为20%硫酸,所需要水的质量为39.2g.
②用到的仪器有:烧杯、玻璃棒和CEF.(填仪器的序号)
A.托盘天平(带砝码盒) B.药匙 C.胶头滴管
D.200mL量筒 E.50mL量筒 F.10mL量筒
③从下表中找出稀释过程需要用到的数据:1.836 g/cm3.
硫酸溶液的密度(单位:g/cm3)
| 质量分数/% | 10℃ | 20℃ | 30℃ |
| 20% | 1.145 | 1.139 | 1.133 |
| 98% | 1.846 | 1.836 | 1.826 |

该同学观察实验现象是浓(填“浓”或“稀”)硫酸使白纸炭化,说明即使是同种酸,由于溶液的浓度或溶质的质量分数不同,它们的性质不完全相同.
(3)某化学学习小组研究硫酸的性质,将20%硫酸溶液放入试管中,如图2所示(装置气密性良好),再向试管中加入某物质后,温度计温度升高,该物质是AE.
A.锌粒 B.冰块 C.铜块
D.氯化钠 E.氢氧化钠.
| A. | 铝被广泛的应用于生产生活中,是因为铝的化学性质稳定 | |
| B. | 使用煤炉要防止中暑,是因为煤不充分燃烧产生的一氧化碳有毒 | |
| C. | 近视镜矫正近视是利用凹透镜对光有会聚作用 | |
| D. | 运动鞋鞋底有花纹是因为增大受力面积从而增大摩擦力 |

| A. | 当水沸腾时,烧杯内气泡上升过程中受到水的压强变大 | |
| B. | 烧杯口有大量的“白气”冒出,这些“白气”是水蒸气遇冷后液化成的小水滴 | |
| C. | 水的沸点为98℃,此时烧杯内水面上方的气压小于1标准大气压 | |
| D. | 水在加热过程中,吸收热量,温度升高;沸腾时,吸收热量,温度不变 |
 一一红磷过量
一一红磷过量
 ”为铜片).
”为铜片).