题目内容
3.木炭作为还原剂用于金属冶炼已有几千年历史.某兴趣小组的同学为了探究木炭在高温条件下还原氧化铜所生成的气体产物是什么,提出了猜想:a.气体产物可能是二氧化碳;
b.气体产物可能是一氧化碳;
c.气体产物可能是二氧化碳和一氧化碳的混合气体.
(1)如果猜想a成立,写出气体产物通入澄清石灰水反应的化学方程式Ca(OH)2+CO2=CaCO3↓+H2O.
(2)如果猜想b成立,写出木炭还原氧化铜反应的化学方程式C+CuO $\frac{\underline{\;高温\;}}{\;}$Cu+CO↑.
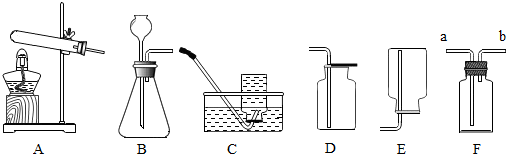
(3)同学们设计了如下图所示装置(铁架台已略去),通过实验探究气体产物的成分.
实验过程中观察到A、E装置中的澄清石灰水均变浑浊,C装置中的澄清石灰水不变浑浊,由此可得出该气体产物的成分为CO2、CO(或“二氧化碳和一氧化碳”).

(4)有同学提出:从简约装置、节约实验药品的角度出发,上图装置可进行改进,去掉A、B、C装置,用如图所示的装置同样可以探究出该气体产物的成分.请你写出其实验操作过程(写出操作步骤,不需要写出现象和结论)点燃酒精灯给CuO加热,观察黑色粉末CuO是否变红,(确定CO是否存在).
分析 (1)根据二氧化碳遇澄清石灰水变浑浊进行判断;
(2)熟记题目假设的是猜想b成立,也就是木炭还原氧化铜生成了CO;
(3)根据二氧化碳遇澄清石灰水变浑浊的特点和一氧化碳与氧化铜反应的现象,进行判断;
(4)先验证生成气体中有二氧化碳,再验证有一氧化碳;
解答 解:
(1)因二氧化碳遇澄清石灰水变浑浊,故气体产物通入澄清石灰水反应后的产物为碳酸钙.反应的化学方程式为:Ca(OH)2+CO2=CaCO3↓+H2O;
(2)由于题目假设是猜想b成立,也就是木炭还原氧化铜生成了CO,所以对应的木炭还原氧化铜的化学反应式是:C+CuO $\frac{\underline{\;高温\;}}{\;}$Cu+CO↑.故答案为:C+CuO $\frac{\underline{\;高温\;}}{\;}$Cu+CO↑.
(3)因二氧化碳能使澄清石灰水变浑浊,所以A中石灰水是确认原混合气体中是否存在CO2;经过B装置后,氢氧化钠溶液可以吸收二氧化碳,C中石灰水是确认CO2是否已经被除尽,排除二氧化碳对下面实验的干扰.而E装置中的澄清石灰水变浑浊,则为一氧化碳还原氧化铜生成的二氧化碳的作用;
故答为:二氧化碳和一氧化碳的混合气体.
(4)从简约装置、节约实验药品的角度出发,上图装置可进行改进,去掉A、B、C装置,用如图所示的装置同样可以探究出该气体产物的成分.故答为:开始时缓缓通入气体产物,观察现象;过一段时间后再加热,观察黑色粉末CuO是否变红(确定CO是否存在).
答案:
(1)Ca(OH)2+CO2=CaCO3↓+H2O;
(2)C+CuO+$\frac{\underline{\;高温\;}}{\;}$Cu+CO↑;
(3)CO2、CO(或“二氧化碳和一氧化碳”)
(4)点燃酒精灯给CuO加热,观察黑色粉末CuO是否变红,(确定CO是否存在).
点评 本题为综合实验题,考查知识面广,要求学生审题仔细,能把所学知识系统化,有发散思维能力,知识归纳能力,平时要加强练习.

| 选项 | 实验目的 | 实验操作 |
| A | 验证 NaCl 溶液中混有盐酸 | 取少量溶液,滴加无色酚酞溶液 |
| B | 除去粗盐中的难溶性杂质 | 将粗盐研碎、溶解、过滤、蒸发 |
| C | 除去铁制品上的铁锈 | 将铁制品长时间浸泡在过量的稀硫酸中 |
| D | 比较 Fe、Cu、Al 的金属活动性 | 铁丝浸入 CuSO4 溶液,铜丝浸入 AgNO3 溶液 |
| A. | A | B. | B | C. | C | D. | D |
【演示实验】将一定量的稀H2SO4加入到盛有NaOH溶液的烧杯中.
【学生板演】该反应的化学方程式H2SO4+2NaOH=Na2SO4+2H2O.
【提出问题】实验中未观察到明显现象,部分同学产生了疑问:反应后溶液中溶质是什么呢?
【猜想】针对疑问大家纷纷提出猜想.甲组同学的猜想如下:
猜想一:只有Na2SO4 猜想二:有Na2SO4和H2SO4
猜想三:有Na2SO4和NaOH 猜想四:有Na2SO4、H2SO4和NaOH
乙组同学对以上猜想提出质疑,认为有一种猜想是不合理的.你认为不合理的猜想是哪一种并说出理由不合理的猜想是猜想四,因为NaOH与H2SO4不能共存.
【继续实验】(1)丙组同学取烧杯中的少量溶液于试管中,滴加几滴CuSO4溶液,无明显变化,溶液中一定没有NaOH.
(2)为了验证其余猜想,各组同学取烧杯中的溶液,并选用老师提供的pH试纸、铜片、BaC12溶液、Na2CO3溶液,分别进行如下三组探究实验.
| 实验方案 | 测溶液pH | 滴加Na2CO3溶液 | 滴加BaCl2溶液 |
| 实验操作 | 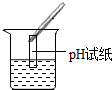 | 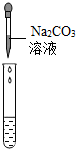 | 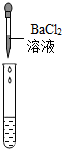 |
| 实验现象 | 试纸变色,比照比色卡,pH<7 | 有气泡产生 | 产生白色沉淀 |
| 实验结论 | 溶液中有H2SO4 | 溶液中有H2SO4 | 溶液中只有H2SO4 |
【评价反思】老师对同学们能用多种方法进行探究,并且得出正确结论给予肯定.同时指出上述三个实验探究中存在两处明显错误,请大家反思.同学们经过反思发现了这两处错误:
(1)实验操作中明显的一处错误是pH试纸浸入溶液中;
(2)实验方案探究中也有一个是不合理的,不合理的原因是BaCl2和Na2SO4反应也会生成白色沉淀,不能证明一定有H2SO4存在.
【实验推广1】你想过复分解反应为什么能够发生吗?这是因为在这些反应物中含有一些“特殊”的阴、阳离子,它们能相互结合.如硫酸和氢氧化钠反应中,实际参加反应的离子是H+和OH-,而SO42-、Na+则是“旁观者”,并没有参加反应.请你分析澄清石灰水和碳酸钠溶液反应中,参加反应的离子是Ca2+和CO32-.
【实验推广2】中和反应是没有现象的,如果要鉴别三瓶液体:稀硫酸,澄清石灰水,食盐水.提供试剂有:(A)酚酞,(B)纯碱溶液,只用一种试剂就可以将这三瓶液体区分出来,则选用试剂可以是B(从提供的试剂中选用)
| A. | ②③④① | B. | ②④③① | C. | ③①④② | D. | ③②④① |
| A. | 32 | B. | 16 | C. | 23 | D. | 46 |
| A. | 在某固体物质中加入稀盐酸,产生大量气泡,该物质一定是碳酸盐 | |
| B. | 在某溶液中加入氯化钡溶液和稀硝酸,产生白色沉淀,该溶液中一定含有硫酸根离子 | |
| C. | 某溶液用pH试纸测试,试纸变蓝色(pH约为10),该溶液一定是碱性溶液 | |
| D. | 将带火星的木条伸入集气瓶中,木条复燃,该气体(氧气)已收集满 |