题目内容
探究性学习是学习化学的重要方法,某化学活动小组进行如下探究.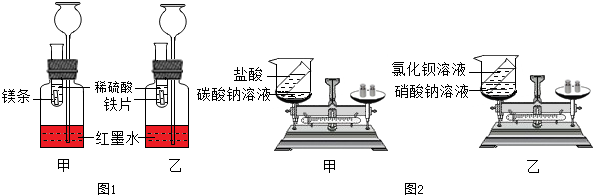
【探究一】探究金属的反应规律,在室温条件下进行如图1所示实验.
已知:试管内的镁条和铁片表面均被打磨洁净,且形状、大小相同,同时加入等质量和等质量分数的稀硫酸.
(1)若比较镁和铁的金属活动性,观察到的现象是 ,说明镁的活动性 铁的活动性.
(2)若比较相同时间内镁、铁与稀硫酸反应放出的热量的多少,长颈漏斗中的现象是 .
(3)若实验所用的金属均过量,则甲装置中产生的H2的质量 (填“大于”、“小于”或“等于”)乙装置中产生的H2质量.
【探究二】探究化学反应前后物质的质量关系.
如图是甲、乙两组同学分别设计的质量守恒定律的两个验证实验.根据如图2所示进行思考回答(假设甲、乙两组药品混合前质量均为m前、混合后质量均为m后).
(1)甲组药品混合前、后质量关系为m前 (填“=”、“<”、“>”)m后,原因是 .
(2)乙组药品混合前、后质量关系为:m前=m后,乙组同学认为实验成功,你认为该实验 (填“能”或“不能”)验证质量守恒定律,原因是 .

【探究一】探究金属的反应规律,在室温条件下进行如图1所示实验.
已知:试管内的镁条和铁片表面均被打磨洁净,且形状、大小相同,同时加入等质量和等质量分数的稀硫酸.
(1)若比较镁和铁的金属活动性,观察到的现象是
(2)若比较相同时间内镁、铁与稀硫酸反应放出的热量的多少,长颈漏斗中的现象是
(3)若实验所用的金属均过量,则甲装置中产生的H2的质量
【探究二】探究化学反应前后物质的质量关系.
如图是甲、乙两组同学分别设计的质量守恒定律的两个验证实验.根据如图2所示进行思考回答(假设甲、乙两组药品混合前质量均为m前、混合后质量均为m后).
(1)甲组药品混合前、后质量关系为m前
(2)乙组药品混合前、后质量关系为:m前=m后,乙组同学认为实验成功,你认为该实验
考点:金属的化学性质,质量守恒定律的实验探究
专题:科学探究
分析:【探究一】(1)金属越活泼,与稀盐酸或稀硫酸反应时速率越快,产生的气泡越多;
(2)考虑镁反应快放热多,因此甲中长颈漏斗里的液面上升得更快;
(3)当金属过量时,与酸反应生成氢气的质量决定于酸的质量;
【探究二】(1)根据甲装置的特点是敞口装置进行分析失败的原因及改进的措施;
(2)根据质量守恒定适用于化学反应进行分析;
(2)考虑镁反应快放热多,因此甲中长颈漏斗里的液面上升得更快;
(3)当金属过量时,与酸反应生成氢气的质量决定于酸的质量;
【探究二】(1)根据甲装置的特点是敞口装置进行分析失败的原因及改进的措施;
(2)根据质量守恒定适用于化学反应进行分析;
解答:解:
【探究一】(1)因为镁比铁活泼,所以分别于等质量、等质量分数的稀硫酸反应时,镁和稀硫酸产生气泡的速率比铁和稀硫酸产生气泡的速率快.
(2)如图1所示实验的目的是:比较镁、铁分别与盐酸反应放热速度;因为镁反应快放热多,因此甲中长颈漏斗里的液面上升得更快.
(3)若镁和铁均过量,则装置甲中产生的H2的质量等于装置乙中产生的H2质量.
①【探究二】(1)由于甲装置是敞口的装置,产生的二氧化碳从烧杯中逸出,总质量减少;改进此装置的方法是:将烧杯改成密闭容器;
(2)质量守恒定适用于化学反应,因为乙组的两种药品未参加化学反应,所以不能验证质量守恒定律.
故答案为:
【探究一】(1)镁和稀硫酸产生气泡的速率比铁和稀硫酸产生气泡的速率快,大于.
(2)因为镁反应快放热多,因此甲中长颈漏斗里的液面上升得更快.
(3)等于.
【探究二】(1)>,由于甲装置是敞口的装置,产生的二氧化碳从烧杯中逸出,总质量减少.
(2)不能,两种药品未参加化学反应
【探究一】(1)因为镁比铁活泼,所以分别于等质量、等质量分数的稀硫酸反应时,镁和稀硫酸产生气泡的速率比铁和稀硫酸产生气泡的速率快.
(2)如图1所示实验的目的是:比较镁、铁分别与盐酸反应放热速度;因为镁反应快放热多,因此甲中长颈漏斗里的液面上升得更快.
(3)若镁和铁均过量,则装置甲中产生的H2的质量等于装置乙中产生的H2质量.
①【探究二】(1)由于甲装置是敞口的装置,产生的二氧化碳从烧杯中逸出,总质量减少;改进此装置的方法是:将烧杯改成密闭容器;
(2)质量守恒定适用于化学反应,因为乙组的两种药品未参加化学反应,所以不能验证质量守恒定律.
故答案为:
【探究一】(1)镁和稀硫酸产生气泡的速率比铁和稀硫酸产生气泡的速率快,大于.
(2)因为镁反应快放热多,因此甲中长颈漏斗里的液面上升得更快.
(3)等于.
【探究二】(1)>,由于甲装置是敞口的装置,产生的二氧化碳从烧杯中逸出,总质量减少.
(2)不能,两种药品未参加化学反应
点评:本题考查质量守恒定律的实验验验证和实验装置的选择,所以正确理解质量守恒定律和根据反应特点,即反应物和生成物中是否有气体或者烟雾,选择什么样的装置是解决本题的关键.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目





