题目内容
(1)人误食重金属盐中毒后,为减轻毒性,最好服用下列物质中的 ( )
| A.水 | B.肥皂水 | C.蛋清 | D.盐水 |
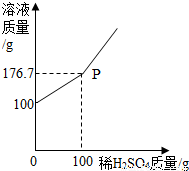
(3)为测定某BaCl2溶液的溶质质量分数,现取100gBaCl2溶液,不断加入稀H2SO4,反应过程中溶液质量与加入稀H2SO4的质量关系如图所示,请回答:
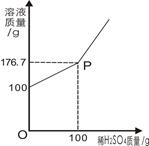
①P点意义_______________。
②反应生成BaSO4沉淀的质量为_________g。
③求原BaCl2溶液的溶质质量分数。
(1) C (2) 没有自由移动的钡离子或BaSO4不溶于胃酸
(3)①完全反应 ②23.3 ③20.8%
解析试题分析:(1)重金属盐可以使蛋白质变性,从而对人体有毒,可以加入蛋清消耗重金属盐;(2)钡离子属于重金属离子,对人体有害,硫酸钡没有自由移动的钡离子或BaSO4不溶于胃酸;(3)①P点是硫酸和氯化钡恰好完全反应的点,②反应生成BaSO4沉淀的质量为加入100g稀硫酸后溶液少增加的质量,为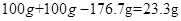 ,
,
③解:设BaCl2质量为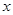
BaCl2+H2SO4=BaSO4 +2HCl
208 233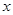 23.3g
23.3g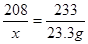
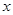
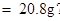
原BaCl2溶液的溶质质量分数为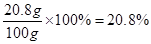
答:原BaCl2溶液的溶质质质量分数为20.8%
考点:化学方程式的计算
点评:这是化学反应联系方程式的计算题,这种题目是每年中考的压轴题,必考题,这类题目的难点在于把坐标曲线表示的意义和题干联系起来。

练习册系列答案
 一线名师提优试卷系列答案
一线名师提优试卷系列答案 阳光试卷单元测试卷系列答案
阳光试卷单元测试卷系列答案
相关题目
 (2013?海陵区二模)(1)人误食重金属盐中毒后,为减轻毒性,最好服用下列物质中的
(2013?海陵区二模)(1)人误食重金属盐中毒后,为减轻毒性,最好服用下列物质中的