题目内容
(1)如图1、图2是钠元素和氯元素在元素周期表中的信息和3种粒子的结构示意图.请回答下列问题:
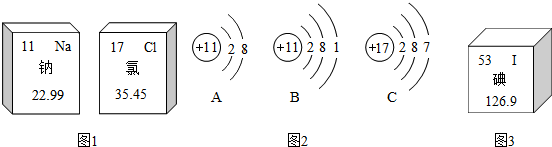
①钠原子与氯原子的最本质区别是 .
②在钠和氯气生成氯化钠的反应中,得到电子的是 原子.
(2)2011年3月11日,日本东北部地区发生9.0级地震,进而引发福岛第一核电站发生爆炸事故,“I-131”一下子引起了人们极大的关注.碘是人体必需的微量元素之一,有“智力元素”之称.结合表和图3的信息回答下列问题:
①m与n 的数值依次是 .(填写数值)
②I-131一旦被人体吸入会引发甲状腺疾病,甚至可能引发甲状腺癌变.服用含碘元素的物质可封闭甲状腺,让放射性碘无法“入侵”.生活中常见的含碘元素的物质为:碘酒--含碘单质I2;碘片和藻类食物--含碘化钾KI;加碘盐--含碘酸钾KIO3.下列对以上物质中碘元素的化合价计算正确的是: (填序号)
A.+1、-1、+5 B.0、+1、+5 C.0、-1、+5.

①钠原子与氯原子的最本质区别是
②在钠和氯气生成氯化钠的反应中,得到电子的是
| 质子数 | 中子数 | 相对原子质量(近似取整) | |
| I-127 | m | 74 | 127 |
| I-131 | 53 | n | 131 |
①m与n 的数值依次是
②I-131一旦被人体吸入会引发甲状腺疾病,甚至可能引发甲状腺癌变.服用含碘元素的物质可封闭甲状腺,让放射性碘无法“入侵”.生活中常见的含碘元素的物质为:碘酒--含碘单质I2;碘片和藻类食物--含碘化钾KI;加碘盐--含碘酸钾KIO3.下列对以上物质中碘元素的化合价计算正确的是:
A.+1、-1、+5 B.0、+1、+5 C.0、-1、+5.
考点:元素周期表的特点及其应用,原子结构示意图与离子结构示意图,原子的有关数量计算,元素的概念,有关元素化合价的计算
专题:化学用语和质量守恒定律
分析:(1)根据元素的概念和最外层电子数与元素化学性质的关系来解答;(2)①根据质子数+中子数=相对原子质量计算;②根据化合价的规定以及在化合物中正负化合价代数和为零进行计算指定元素化合价.
解答:解:(1)①一种原子与另一种原子的根本区别在于质子数不同;②最外层电子数少于4个,易失去最外层电子,钠原子最外层有1个电子,在化学变化中易失去最外层的电子,而氯原子最外层有7个电子,多余4个,在化学变化中易得到电子;
(2)根据相等原子质量=质子数+中子数,m与n 的数值依次是=53、78.
③单质中,元素的化合价为零,故碘单质的化合价是0;在化合物中正负化合价代数和为零,KI中钾为+1价,I就为-1KIO3中碘元素的化合价为:(+1)+x+(-2)×3=0,则x=+5,故选C.
故答案为:(1)①质子数不同;②氯;(2)①53、78;②C.
(2)根据相等原子质量=质子数+中子数,m与n 的数值依次是=53、78.
③单质中,元素的化合价为零,故碘单质的化合价是0;在化合物中正负化合价代数和为零,KI中钾为+1价,I就为-1KIO3中碘元素的化合价为:(+1)+x+(-2)×3=0,则x=+5,故选C.
故答案为:(1)①质子数不同;②氯;(2)①53、78;②C.
点评:本题主要考查学生运用所学化学知识综合分析和解决实际问题的能力.学生分析问题的思维跨度较大,强调了学生整合知识的能力,以及对信息的分析、提炼、加工、运用的能力.

练习册系列答案
 孟建平名校考卷系列答案
孟建平名校考卷系列答案
相关题目
要区分二氧化碳、氧气两瓶无色气体,下列方法中不可行的是( )
| A、加入适量氢氧化钠溶液 |
| B、加入适量澄清石灰水 |
| C、加入适量紫色石蕊试液 |
| D、将燃着的木条伸入瓶口内 |
试验室现有足量的20%的NaOH溶液,欲配制15%的NaOH溶液100g,需要加水的量是( )
| A、75g | B、100g |
| C、25g | D、200g |
下列说法中正确的是( )
| A、在用加热高锰酸钾制取氧气的反应中二氧化锰是催化剂 |
| B、工业上利用氧气和氮气的沸点不同,从液态空气中分离出氧气的过程属分解反应 |
| C、细铁丝在空气里剧烈燃烧、火星四射 |
| D、空气质量报告中所列的空气质量级别越大,空气质量越差 |
 碘元素对人体健康起着重要的作用.碘酸钾(KIO3)是食盐中主要的加碘剂.
碘元素对人体健康起着重要的作用.碘酸钾(KIO3)是食盐中主要的加碘剂. 碳酸氢铵是农业生产上常用的一种氮肥.如图是某化肥厂生产的碳酸氢铵化肥包装袋上标签的部分文字.请你通过计算填写下列空白:(计算结果精确到0.1%).
碳酸氢铵是农业生产上常用的一种氮肥.如图是某化肥厂生产的碳酸氢铵化肥包装袋上标签的部分文字.请你通过计算填写下列空白:(计算结果精确到0.1%). 某混合溶液中可能含有硝酸、硫酸、氯化镁中的一种或几种,取一定量的混合溶液中逐滴加入氢氧化钡溶液的体积与产生沉淀情况如图所示:
某混合溶液中可能含有硝酸、硫酸、氯化镁中的一种或几种,取一定量的混合溶液中逐滴加入氢氧化钡溶液的体积与产生沉淀情况如图所示: