题目内容
7.粗盐中除NaCl外,还含有MgCl2、CaCl2、MgSO4以及泥沙等杂质,他们要除去杂质得到精盐,设计了下列实验方案(序号①~⑧表示实验操作,用于沉淀的试剂稍过量):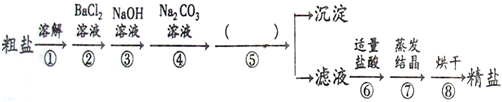
根据上述方案,回答下列问题:
(1)操作①中玻璃棒的作用是加速粗盐的溶解速率.
(2)第⑤步操作的名称是过滤.
(3)“蒸发结晶”用到的仪器有:铁架台、坩埚钳、石棉网、玻璃棒、酒精灯、蒸发皿.
(4)实验中加入“Na2CO3溶液”的目的是除去CaCl2、BaCl2.
分析 (1)根据玻璃棒可以加快液体的流动,加快了水对氯化钠的冲刷等知识解答;
(2)通过第五步的操作里可以将固体和液体分离,进行判断;
(3)在蒸发氯化钠时需要有加热装置,需要有盛放液体进行加热的装置,蒸发皿是热的不良导体,酒精灯在加热时,会使蒸发皿受热不均;
(4)根据会与碳酸根离子生成沉淀的有哪些物质进行分析.
解答 解:(1)玻璃棒在溶液中的转动可以加速溶液对氯化钠的冲刷,是粗盐在水中的溶解速率加快;
(2)过滤是将溶液和不溶性的固体进行分离的一种操作,而经过⑤步的操作后分出了滤液和沉淀两部分;
(3)在对粗盐进行蒸发结晶的过程中,除了题中提供的仪器外,还需要盛放液体进行结晶的装置,故答案为:蒸发皿;
(4)碳酸钠中的碳酸根离子会与钡离子和钙离子反应生成碳酸钡和碳酸钙沉淀,故答案为:除去CaCl2、BaCl2.
故答案为:(1)加速粗盐的溶解速率;
(2)过滤
(3)蒸发皿;
(4)除去CaCl2和过量的BaCl2.
点评 注意混合物的分离方法,探究实验操作的注意事项,熟练常用仪器的名称和选用,探究物质除杂和净化.

练习册系列答案
 名师导航单元期末冲刺100分系列答案
名师导航单元期末冲刺100分系列答案 名校名卷单元同步训练测试题系列答案
名校名卷单元同步训练测试题系列答案
相关题目
17.小亮在实验室发现一瓶盛有无色溶液的试剂瓶,其标签破损,从残余部分只能看出溶质的质量分数为10%,具体是什么物质无法辨认.老师告诉他,这瓶溶液可能是氢氧化纳、氯化钠、氢氧化钙或是碳酸钠中的一种.
(1)小亮查阅氢氧化钙常温下的溶解度为0.18g后,认为该溶液不可能是氢氧化钙,理由是Ca(OH)2微溶于水,常温下不可能得到10%的氢氧化钙溶液.
(2)小亮取少量样品于试管中,滴加无色酚酞 试液,试液变红色,该溶液不可能是NaCl(填写化学式),理由是NaCl溶液呈中性,不能使无色酚酞试液变红色.
(3)为了确定该溶液的成分,小亮同学继续进行下列实验,请一起参与,并填写下列实验报告.
【设计实验方案】方案甲:选择氯化钙溶液来确定该溶液的成份;方案乙:选择稀盐酸来确定该溶液的成份.
【进行实验】
(4)玉鹏同学认为还可以用一种不同于甲、乙类别的物质来确定,请你帮他完成,该物质可以为石灰水.
(1)小亮查阅氢氧化钙常温下的溶解度为0.18g后,认为该溶液不可能是氢氧化钙,理由是Ca(OH)2微溶于水,常温下不可能得到10%的氢氧化钙溶液.
(2)小亮取少量样品于试管中,滴加无色酚酞 试液,试液变红色,该溶液不可能是NaCl(填写化学式),理由是NaCl溶液呈中性,不能使无色酚酞试液变红色.
(3)为了确定该溶液的成分,小亮同学继续进行下列实验,请一起参与,并填写下列实验报告.
【设计实验方案】方案甲:选择氯化钙溶液来确定该溶液的成份;方案乙:选择稀盐酸来确定该溶液的成份.
【进行实验】
| 实验步骤 | 实验现象 | 实验结论 |
| 取少量溶液于试管中,滴加氯化钙溶液(或稀盐酸). | 产生白色沉淀(或有气泡冒出) | 该溶液是碳酸钠溶液. 有关反应的化学方程式为: CaCl2+Na2CO3=CaCO3↓+2NaCl(或Na2CO3+2HCl=2NaCl+H2O+CO2↑). |
| 实验步骤 | 实验现象 | 实验结论 |
| 取少量溶液于试管中,滴加该物质 | 产生白色沉淀 | 该溶液是碳酸钠溶液.有关反应的化学方程式为:Ca(OH)2+Na2CO3═CaCO3↓+2NaOH |
12.把铝箔放入CuCl2溶液中,铝箔表面覆盖了红色物质,其反应的化学方程式为2Al+3CuCl2═3Cu+2AlCl3; 一会儿又有大量气泡冒出,某研究小组对“放出气体“这一异常现象进行了如下探究:
探究一:产生气体的原因
【猜想与假设】猜想1:与CuCl2溶液中Cu2+有关;
猜想2:与CuCl2溶液中Cl-有关;
猜想3:与CuCl2溶液中水分子有关;
…
【实验探究】请设计实验,验证猜想1.
探究二:气体的成分
【猜想与假设】小华说:该气体可能是CO2、O2、H2.
小明说:不可能含有CO,.因为反应物中不含碳元素,根据质量守恒定律不可能有一氧化碳产生.
小英将燃着的木条伸入反应的试管中,发现该气体能燃烧,并且产生淡蓝色火焰,则该气体是氢气.
探究一:产生气体的原因
【猜想与假设】猜想1:与CuCl2溶液中Cu2+有关;
猜想2:与CuCl2溶液中Cl-有关;
猜想3:与CuCl2溶液中水分子有关;
…
【实验探究】请设计实验,验证猜想1.
| 实验操作 | 实验现象及结论 |
| 把铝放入NaCl溶液中, 把铝的CuCl2溶液中, | 无气泡产生,说明与氯离子无关, 有气泡产生;说明与铜离子有关 |
【猜想与假设】小华说:该气体可能是CO2、O2、H2.
小明说:不可能含有CO,.因为反应物中不含碳元素,根据质量守恒定律不可能有一氧化碳产生.
小英将燃着的木条伸入反应的试管中,发现该气体能燃烧,并且产生淡蓝色火焰,则该气体是氢气.
19.用化学用语表示:
| 空气中含量最多的物质 | 2个二氧化硫分子 | 氦气 | 3个铁离子 | 2个铵根离子 | 2个硫酸分子 | 3个硝酸根离子 | 标出氯化铵中氮元素化合价 | |
| 符 号 |
16.张鑫同学取用生石灰时,发现装满生石灰的塑料试剂瓶已经膨胀破裂.为此他所在的小组同学进行了如下探究:
【提出问题】该生石灰是否变质?其主要成分是什么?
【猜想假设】张鑫认为生石灰肯定已变质,因为空气成分中含有水和二氧化碳.
他猜想其主要成分可能含有CaO、Ca(OH)2、CaCO3等三种物质
【实验探究】(1)张鑫取一定量样品于烧杯中,加入适量的水充分搅拌,用手触摸烧杯外壁,没有明显现象,由此说明该样品中不含有CaO;
(2)将上述液体过滤,得到滤液和滤渣.小组同学进一步探究,确定滤渣的成分是什么?
【反思评价】小组同学得出的结论是该生石灰已完全变质,只含有Ca(OH)2和CaCO3,没有CaO,你认为
不合理(填不合理或合理),理由是如果CaO量很少,氧化钙能与水反应放出的热少,可能感觉不到.
【提出问题】该生石灰是否变质?其主要成分是什么?
【猜想假设】张鑫认为生石灰肯定已变质,因为空气成分中含有水和二氧化碳.
他猜想其主要成分可能含有CaO、Ca(OH)2、CaCO3等三种物质
【实验探究】(1)张鑫取一定量样品于烧杯中,加入适量的水充分搅拌,用手触摸烧杯外壁,没有明显现象,由此说明该样品中不含有CaO;
(2)将上述液体过滤,得到滤液和滤渣.小组同学进一步探究,确定滤渣的成分是什么?
| 实验操作步骤 | 实验现象 | 实验结论 |
| ①取少量滤渣于试管中加入稀盐酸稀盐酸 | 有气泡产生 | 说明滤渣中含有CaCO3. |
| ②取少量滤渣于试管中,再加水搅拌溶解,再滴入几滴无色酚酞溶液 | 溶液变成红色 | 说明滤渣中含有Ca(OH)2. |
不合理(填不合理或合理),理由是如果CaO量很少,氧化钙能与水反应放出的热少,可能感觉不到.


 下图中甲、乙、丙是初中化学中常见的物质,图中“-”表示相连的物质之间可以在溶液中发生化学反应,“→”表示由某种物质可转化为另一种物质(部分反应物、生成物及反应条件已略去).
下图中甲、乙、丙是初中化学中常见的物质,图中“-”表示相连的物质之间可以在溶液中发生化学反应,“→”表示由某种物质可转化为另一种物质(部分反应物、生成物及反应条件已略去).