题目内容
7.将Cu2O和Cu的固体混合物5.2g放入烧杯中,加入过量的20%的稀硫酸,充分反应后,过滤、洗涤、干燥,得到3.2g固体.下列说法错误的是(已知:Cu2O+H2SO4═CuSO4+Cu+H2O)( )| A. | 剩余固体为纯净物 | |
| B. | 反应过程中,溶液逐渐变蓝 | |
| C. | 原固体混合物中Cu的质量大于Cu2O | |
| D. | 在最后一次洗涤后的滤液中滴加BaCl2溶液,检验固体是否洗涤干净 |
分析 铜不能和稀硫酸反应,将Cu2O和Cu的固体混合物5.2g放入烧杯中,加入过量的20%的稀硫酸,充分反应后,过滤、洗涤、干燥,得到的3.2g固体是铜;
钡离子能和硫酸根离子结合成白色沉淀硫酸钡.
解答 解:A、充分反应后,过滤、洗涤、干燥,得到的3.2g固体是铜,因此剩余固体为纯净物,该选项说法正确;
B、反应过程中,生成硫酸铜,硫酸铜溶液是蓝色溶液,因此溶液逐渐变蓝,该选项说法正确;
C、设氧化亚铜质量为x,
Cu2O+H2SO4═CuSO4+Cu+H2O,
144 64
x $\frac{64x}{144}$
由题意可知,5.2g-x+$\frac{64x}{144}$=3.2g,
x=3.6g,
原固体混合物中Cu的质量为:5.2g-3.6g=1.6g,
因此原固体混合物中Cu的质量小于Cu2O的质量,该选项说法不正确;
D、在最后一次洗涤后的滤液中滴加BaCl2溶液,根据是否产生沉淀可以检验固体是否洗涤干净,该选项说法正确.
故选:C.
点评 本题主要考查物质的性质,解答时要根据各种物质的性质,结合各方面条件进行分析、判断,从而得出正确的结论.

练习册系列答案
相关题目
20.下列曲线示意图与相应选项表示不正确的是( )
| A. |  表示稀盐酸中滴加蒸馏水 | |
| B. |  表示等体积、等质量分数的过氧化氢溶液分解 | |
| C. |  表示质量、颗粒大小都相等的金属中加稀盐酸 | |
| D. |  表示HCl和FeCl3的混合溶液中滴加NaOH溶液 |
15.下列说法正确的是( )
| A. | 洗洁精和汽油都能清洗油污,其原理不相同 | |
| B. | 酸碱中和反应生成盐和水,生成盐和水的反应不一定是中和反应 | |
| C. | 溶液结晶后溶质减少,所以饱和溶液结晶后溶质的质量分数一定减小 | |
| D. | 向久置于空气的氢氧化钠溶液中滴入酚酞试液,溶液变红,说明氢氧化钠溶液未变质 |
12.下面是利用化学知识对有关事实的解释,其中不正确的是( )
| A. | 生铁和钢的性能不同,与它们的组成中含碳量不同有关 | |
| B. | 铁丝在空气中不能被点燃,与空气中氧气的体积分数有关 | |
| C. | 氢氧化钠和氢氧化钙化学性质相似,与它们的水溶液中都含有OH-有关 | |
| D. | 金属铝比铁更耐腐蚀,与它们的金属活动性顺序有关 |
16.垃圾分类从我做起,金属饮料罐属于( )
| A. |  可回收物 | B. |  有害垃圾 | C. |  厨余垃圾 | D. |  其他垃圾 |
14.我们生活在不断变化的物质世界中,下列变化属于物理变化的是( )
| A. | 蜡烛的燃烧 | B. | 二氧化碳使澄清石灰水变浑浊 | ||
| C. | 铁钉在潮湿的空气中生锈 | D. | 直饮水机中活性炭吸附杂质 |
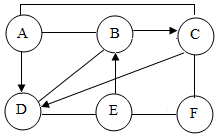 现有A、B、C、D、E、F六种初中化学常见的物质,在常温下A、B为气体单质,且B气体在同等条件下是密度最小的气体,C常用作导线的内部材料,C和D含有相同元素,E是一种溶液,溶质是由两种元素组成的化合物,用两圆间的“──”表示两种物质可以发生化学反应,箭头“→”表示一种物质能转化为另一种物质.请回答下列问题:(以上反应均在初中知识范围内)
现有A、B、C、D、E、F六种初中化学常见的物质,在常温下A、B为气体单质,且B气体在同等条件下是密度最小的气体,C常用作导线的内部材料,C和D含有相同元素,E是一种溶液,溶质是由两种元素组成的化合物,用两圆间的“──”表示两种物质可以发生化学反应,箭头“→”表示一种物质能转化为另一种物质.请回答下列问题:(以上反应均在初中知识范围内)
 质量守恒定律的发现对化学的发展做出了重要贡献.
质量守恒定律的发现对化学的发展做出了重要贡献.