题目内容
3.如何用化学方法区分家庭中常用的食盐和食用纯碱?写出简单的步骤.分析 根据食盐和纯碱的性质差异进行分析解答即可.
解答 解:纯碱是碳酸钠,能与盐酸反应产生二氧化碳气体,而食盐不与盐酸反应,故可以使用盐酸鉴别二者,故答案为:分别取固体样品加入试管中,然后分别滴加盐酸,有气泡产生的是纯碱,无现象的是食盐.
点评 本题考查的是常见的物质的鉴别,完成此题,可以依据已有的物质的性质差异进行.

练习册系列答案
 一诺书业暑假作业快乐假期云南美术出版社系列答案
一诺书业暑假作业快乐假期云南美术出版社系列答案
相关题目
2.实验探究是化学的灵魂,请你参与实验室制取二氧化碳的探究活动.
Ⅰ.制取二氧化碳原料的选择
(1)实验室常用大理石或石灰石(主要成分CaCO3)与稀盐酸反应制取二氧化碳,反应的化学方程式为CaCO3+2HCl═CaCl2+H2O+CO2↑.
(2)实验过程中,同学们提出了下列问题,并在老师指导下进行实验.
[问题一]能否用稀硫酸与块状石灰石反应制取二氧化碳?
[实验一]
[分析一]实验室不能(填“能”或“不能”)用稀硫酸与块状石灰石反应制取二氧化碳.
[问题二]能否用粉末状石灰石、碳酸钙粉末或碳酸钠粉末与稀盐酸反应制取二氧化碳?
[实验二]
[分析二]实验室不选用石灰石粉末、碳酸钙粉末或碳酸钠粉末制取二氧化碳的理由是反应速率太快,不利于二氧化碳的收集.
[结论]实验室制取二氧化碳,原料通常用块状石灰石(或大理石)和稀盐酸.
Ⅱ.拓展与反思:通过探究活动,你认为选择实验方法时应考虑的因素有反应速率(写一种).
Ⅰ.制取二氧化碳原料的选择
(1)实验室常用大理石或石灰石(主要成分CaCO3)与稀盐酸反应制取二氧化碳,反应的化学方程式为CaCO3+2HCl═CaCl2+H2O+CO2↑.
(2)实验过程中,同学们提出了下列问题,并在老师指导下进行实验.
[问题一]能否用稀硫酸与块状石灰石反应制取二氧化碳?
[实验一]
| 实验步骤 | 实验现象 |
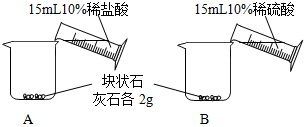 | A中不断产生气泡,固 体逐渐减少,有少量固体 剩余. B中开始有少量气泡产 生,反应很快停止. |
[问题二]能否用粉末状石灰石、碳酸钙粉末或碳酸钠粉末与稀盐酸反应制取二氧化碳?
[实验二]
| 实验步骤 | 实验现象 |
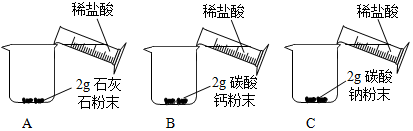 | A中迅速产生大量 气泡,固体很快减少, 有少量固体剩余. B、C中都迅速产生 大量气泡,固体很快 消失. |
[结论]实验室制取二氧化碳,原料通常用块状石灰石(或大理石)和稀盐酸.
Ⅱ.拓展与反思:通过探究活动,你认为选择实验方法时应考虑的因素有反应速率(写一种).
6.属于同素异形体的一组物质是( )
| A. | 氧气和液氧 | B. | 石墨和金刚石 | ||
| C. | 水和双氧水 | D. | 一氧化碳和二氧化碳 |
 化学小组同学用如图所示装置探究铁的金属活动性.
化学小组同学用如图所示装置探究铁的金属活动性.
