题目内容
3.关于金属及其合金的说法正确的是( )| A. | 自然界中大多数金属以化合物形式存在 | |
| B. | 所有金属的颜色都是银白色 | |
| C. | 黄铜的硬度比纯铜的硬度小 | |
| D. | 生铁可以完全溶解在足量稀盐酸中 |
分析 A、自然界中大多数金属以化合物形式存在;
B、根据常见金属的颜色,进行分析判断;
C、根据合金的性质来分析;
D、根据生铁的主要成分是铁,含有碳等杂质,进行分析判断.
解答 解:A、自然界中大多数金属以化合物形式存在,正确;
B、金属的颜色不一定都是银白色的,铜呈紫红色,错误;
C、金的硬度比组成它的金属的硬度大,黄铜是铜锌合金,故黄铜的硬度比纯铜大,错误;
D、生铁的主要成分是铁,含有碳等杂质,铁能与稀盐酸反应,但碳不与稀盐酸反应,生铁不能完全溶解在足量稀盐酸中,错误.
故选A.
点评 本题难度不大,完成此题,可以依据已有的知识进行.

练习册系列答案
 暑假作业海燕出版社系列答案
暑假作业海燕出版社系列答案 本土教辅赢在暑假高效假期总复习云南科技出版社系列答案
本土教辅赢在暑假高效假期总复习云南科技出版社系列答案 暑假作业北京艺术与科学电子出版社系列答案
暑假作业北京艺术与科学电子出版社系列答案 第三学期赢在暑假系列答案
第三学期赢在暑假系列答案
相关题目
14.废铁屑的主要成份是铁,同时还有少量铁锈(Fe 2O 3),动物饲料硫酸亚铁的生产工艺之一如下图所示:
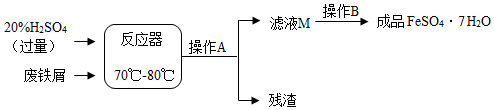
(1)在反应器中发生反应的化学方程式除Fe2(SO4)3+Fe=3FeSO4外还有:Fe+H2SO4=FeSO4+H2↑,Fe2O3+3H2SO4═Fe2(SO4)3+3H2O;
(2)滤液M中肯定含有的溶质的化学式是FeSO4、H2SO4、;
(3)在实验室中完成操作A的玻璃仪器有玻璃棒、烧杯和漏斗;
(4)滤液M经过操作B可得硫酸亚铁晶体(FeSO47H2O).已知硫酸亚铁的溶解度和析出晶体的组成如下表:
根据溶解度表,硫酸亚铁晶体(FeSO47H2O)冷却结晶温度最高不超过64℃;
(5)在化学反应中,若有元素化合价变化的反应定义为氧化还原反应.下列反应类型肯定是氧化还原反应的是B(填字母编号).
A.化合反应 B.置换反应 C.分解反应 D.复分解反应
硫酸亚铁晶体加强热会发生反应2FeSO4•7H2O $\frac{\underline{\;高温\;}}{\;}$Fe 2O 3+SO2+X+7H2O 其生成物X的化学式SO3,该反应是(填“是”或“不是”)氧化还原反应.

(1)在反应器中发生反应的化学方程式除Fe2(SO4)3+Fe=3FeSO4外还有:Fe+H2SO4=FeSO4+H2↑,Fe2O3+3H2SO4═Fe2(SO4)3+3H2O;
(2)滤液M中肯定含有的溶质的化学式是FeSO4、H2SO4、;
(3)在实验室中完成操作A的玻璃仪器有玻璃棒、烧杯和漏斗;
(4)滤液M经过操作B可得硫酸亚铁晶体(FeSO47H2O).已知硫酸亚铁的溶解度和析出晶体的组成如下表:
| 温度/℃ | 0 | 10 | 30 | 40 | 50 | 60 | 64 | 70 | 80 | 90 | ||
| 溶解度/g | 15.6 | 20.5 | 33.0 | 40.4 | 48.8 | 55.0 | 55.3 | 50.6 | 43.7 | 37.2 | ||
| 析出晶体 | FeSO4•7H2O | FeSO4•4H2O | FeSO4•H2O | |||||||||
(5)在化学反应中,若有元素化合价变化的反应定义为氧化还原反应.下列反应类型肯定是氧化还原反应的是B(填字母编号).
A.化合反应 B.置换反应 C.分解反应 D.复分解反应
硫酸亚铁晶体加强热会发生反应2FeSO4•7H2O $\frac{\underline{\;高温\;}}{\;}$Fe 2O 3+SO2+X+7H2O 其生成物X的化学式SO3,该反应是(填“是”或“不是”)氧化还原反应.
18.经常食用海带、紫菜可以预防甲状腺疾病是因为它们富含的元素是( )
| A. | Cl | B. | Zn | C. | Fe | D. | I |
8.下列对比实验不能实现相应目的是( )
| A. |  鉴别CO与H2 | B. |  比较微粒间空隙大小 | ||
| C. |  探究铁生锈 需要与水接触 | D. |  探究物质燃烧需要与氧气接触 |
15.下列有关元素的说法中正确的是( )
| A. | 元素是具有相同质子数的粒子的总称 | |
| B. | 元素的原子序数与该元素原子的核电荷数相同 | |
| C. | 由同种元素组成的物质一定是单质 | |
| D. | 在物质发生化学变化时,元素种类可能会变 |
12.焊接金属时,能用作保护气的一组气体是( )
| A. | H2 N2 | B. | N2 O2 | C. | CO2 CO | D. | N2 Ar |
 (1)请从H、C、O、Ca、Fe五种元素中选一种或几种元素,写出符合下列要求的化学式或名称.
(1)请从H、C、O、Ca、Fe五种元素中选一种或几种元素,写出符合下列要求的化学式或名称.