题目内容
课外兴趣小组对一批锌样品(含有杂质,杂质不溶于水,也不与稀硫酸反应)进行分析,甲、乙、丙三位同学分别实验,其中只有一位同学取用的稀硫酸与锌样品要恰好完全反应.实验数据如下表:(其中烧杯的质量为25g) 请你认真分析数据,回答下列问题:
| 甲 | 乙 | 丙 | |
| 烧杯25g+稀硫酸 | 225 | 175 | 175 |
| 加入锌样品 | 10 | 10 | 15 |
| 充分反应后 烧杯25g+剩余物 | 234.7 | 184.7 | 189.7 |
( 2)计算完全反应时原硫酸溶液中溶质的质量分数?
解:根据表格中的数据和计算可得:
比较甲和乙可知,当锌的质量是10克时,150克硫酸和200克硫酸与锌生成的氢气的质量都是0.3克,说明10克锌和150克硫酸反应时,10克锌全部参加反应.比较乙和丙可知,当硫酸的质量是150克时,10克锌和15克锌与硫酸反应生成的氢气的质量都是0.3克,说明10克锌和150硫酸反应时,150克硫酸全部参加反应.综合分析,乙中物质恰好完全反应.
(1)设生成0.3克氢气需要锌的质量是X,需要硫酸的质量是Y.
Zn+H2SO4═ZnSO4+H2↑
65 98 2
X Y 0.3克
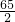 ═
═
得:X=9.75克
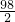 ═
═
得:Y=14.7克
∴锌样品中锌的质量分数= ×100%=97.5%.
×100%=97.5%.
(2)由(1)计算得硫酸的质量是14.7克,原硫酸溶液中溶质的质量分数= ×100%═9.8%.
×100%═9.8%.
答:锌样品中锌的质量分数为97.5%;原硫酸溶液中溶质的质量分数为9.8%.
分析:比较三组实验数据可以发现,甲:锌样品的质量是10克,稀硫酸的质量=225克-25克=200克,剩余物的质量=234.7克-25克=209.7克,则放出氢气的质量=10克+200克-209.7克=0.3克;乙:锌样品的质量是10克,稀硫酸的质量=175克-25克=150克,剩余物的质量=184.7克-25克=159.7克,则放出氢气的质量=10克+150克-159.7克=0.3克.丙:锌样品的质量是15克,稀硫酸的质量=175克-25克=150克,剩余物的质量=189.7克-25克=164.7克,则放出氢气的质量=15克+150克-164.7克=0.3克.比较三组实验数据可以发现,乙恰好完全反应.
点评:本题的关键是判断哪组实验恰好完全反应,记住:比较性问题一般只能有一个变量,这样不同的结果才可以说是有“不同的变量”引起的.
| 甲 | 乙 | 丙 | |
| 稀硫酸的质量 | 200 | 150 | 150 |
| 锌的质量 | 10 | 10 | 15 |
| 氢气的质量 | 0.3 | 0.3 | 0.3 |
(1)设生成0.3克氢气需要锌的质量是X,需要硫酸的质量是Y.
Zn+H2SO4═ZnSO4+H2↑
65 98 2
X Y 0.3克
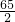 ═
═
得:X=9.75克
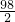 ═
═
得:Y=14.7克
∴锌样品中锌的质量分数=
 ×100%=97.5%.
×100%=97.5%.(2)由(1)计算得硫酸的质量是14.7克,原硫酸溶液中溶质的质量分数=
 ×100%═9.8%.
×100%═9.8%.答:锌样品中锌的质量分数为97.5%;原硫酸溶液中溶质的质量分数为9.8%.
分析:比较三组实验数据可以发现,甲:锌样品的质量是10克,稀硫酸的质量=225克-25克=200克,剩余物的质量=234.7克-25克=209.7克,则放出氢气的质量=10克+200克-209.7克=0.3克;乙:锌样品的质量是10克,稀硫酸的质量=175克-25克=150克,剩余物的质量=184.7克-25克=159.7克,则放出氢气的质量=10克+150克-159.7克=0.3克.丙:锌样品的质量是15克,稀硫酸的质量=175克-25克=150克,剩余物的质量=189.7克-25克=164.7克,则放出氢气的质量=15克+150克-164.7克=0.3克.比较三组实验数据可以发现,乙恰好完全反应.
点评:本题的关键是判断哪组实验恰好完全反应,记住:比较性问题一般只能有一个变量,这样不同的结果才可以说是有“不同的变量”引起的.

练习册系列答案
相关题目
某校课外兴趣小组对一批粗锌样品(含有杂质,杂质不溶于水,也不与酸反应)进行分析,甲、乙、丙三组同学分别进行实验,实验数据记录如下:
请你认真分析数据,帮助他们回答下列问题(每组反应均充分):
(1) 组同学所取用的稀硫酸与粗锌样品恰好完全反应;
(2)计算粗锌样品中锌的质量分数;
(3)计算原硫酸溶液中溶质的质量分数;
(4)计算恰好完全反应的那组实验所得溶液中溶质的质量分数.(烧杯质量为52.5g,计算结果精确到0.1%) .
| 药品 组别 | 甲 | 乙 | 丙 |
| 烧杯+稀硫酸/g | 152.5 | 152.5 | 252.5 |
| 粗锌样品 | 20 | 15 | 15 |
| 烧杯及剩余物/g | 172.1 | 167.1 | 267.1 |
(1)
(2)计算粗锌样品中锌的质量分数;
(3)计算原硫酸溶液中溶质的质量分数;
(4)计算恰好完全反应的那组实验所得溶液中溶质的质量分数.(烧杯质量为52.5g,计算结果精确到0.1%)
某校课外兴趣小组对一批粗锌样品(含有杂质,杂质不与酸反应)进行分析,他们取一些粗锌样品恰好与100克稀硫酸完全反应生成0.4克氢气.
(1)计算粗锌样品中锌的质量;
(2)计算稀硫酸溶液中溶质的质量分数.
(1)计算粗锌样品中锌的质量;
(2)计算稀硫酸溶液中溶质的质量分数.
某课外兴趣小组对一批锌样品(含有杂质,杂质不溶于水,也不与稀硫酸反应)进行分析,甲、乙、丙三位同学分别进行实验,其中只有一位同学所取用的稀硫酸与锌样品恰好完全反应。实验数据如下表:
| 甲 | 乙 | 丙 | |
| 烧杯+稀硫酸 | 150g | 100g | 100g |
| 加入的锌样品 | 8g | 8g | 10g |
| 充分反应后,烧杯+剩余物 | 157.8g | 107.8g | 109.8g |
请你认真分析数据,回答下列问题:
(1)哪位同学所取用的稀硫酸与锌样品恰好完全反应;
(2)计算样品中锌的质量分数;
(3)计算恰好完全反应后所得溶液中溶质的质量分数。
(烧杯的质量为25.4g;计算结果精确到1%)