题目内容
5.有六种物质:A食盐;B熟石灰;C稀盐酸;D硝酸钾;E明矾;F碳酸氢钠.请据此回答(填字母).①常用于改良酸性土壤B;②可用于金属除锈的是C;③属于复合肥料的是D;④可用于治疗胃酸过多的是F;⑤常用作净水剂的是E;
⑥常用于食品调味的是A.
分析 物质的性质决定物质的用途,根据已有的物质的性质进行分析解答即可.
解答 解:①常用于改良酸性土壤的是熟石灰氢氧化钙,故填:B;
②盐酸能与金属氧化物反应,可用于金属除锈,故填:C;
③硝酸钾含有氮元素和钾元素两种元素,属于复合肥料,故填:D;
④可碳酸氢钠能与盐酸反应,可以用于治疗胃酸过多,故填:F;
⑤明矾溶于水形成的胶体具有吸附性,常用作净水剂,故填:E;
⑥食盐常用于食品调味,故填:A.
点评 本题考查的是常见的物质的用途,完成此题,可以依据已有的物质的性质进行.

练习册系列答案
相关题目
17.在学习碱的化学性质时,某兴趣小组进行了如图所示的实验.
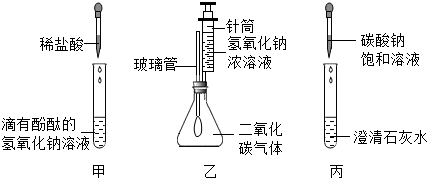
I.实验记录:
①甲实验过程中,能证明发生化学变化的现象是溶液的红色逐渐消失,该反应的化学方程式是NaOH+HCl=NaCl+H2O;
②乙实验中滴加氢氧化钠溶液后,可观察到的现象是气球胀大,该反应的化学方程式是2NaOH+CO2=Na2CO3+H2O;
③丙实验中观察到试管内有白色沉淀产生,该反应的化学方程式是Na2CO3+Ca(OH)2═CaCO3↓+2NaOH;
Ⅱ.废液成分探究:
实验结束后,同学们将甲、乙、丙三个实验的废液倒入同一个干净的废液缸中,最终看到废液浑浊并呈红色,由此产生疑问.
【提出问题】废液中含有哪些物质?
【讨论交流】
①废液中一定含有的物质:碳酸钙、指示剂、水和NaCl;
②还含有能使废液呈碱性的物质.能使废液呈碱性的物质是什么?同学们有如下猜想:
猜想1:是碳酸钠;
猜想2:是氢氧化钠;
猜想3:是氢氧化钠和碳酸钠;
你的另一猜想是:氢氧化钙(写一种猜想).
【实验设计】用氯化钙溶液来验证上述猜想.
查阅资料获悉氯化钙溶液呈中性,并设计如下实验.请将实验设计补充完整.
③要验证你的猜想,所需要的试剂和预计的现象分别是加入二氧化碳、出现白色沉淀.

I.实验记录:
①甲实验过程中,能证明发生化学变化的现象是溶液的红色逐渐消失,该反应的化学方程式是NaOH+HCl=NaCl+H2O;
②乙实验中滴加氢氧化钠溶液后,可观察到的现象是气球胀大,该反应的化学方程式是2NaOH+CO2=Na2CO3+H2O;
③丙实验中观察到试管内有白色沉淀产生,该反应的化学方程式是Na2CO3+Ca(OH)2═CaCO3↓+2NaOH;
Ⅱ.废液成分探究:
实验结束后,同学们将甲、乙、丙三个实验的废液倒入同一个干净的废液缸中,最终看到废液浑浊并呈红色,由此产生疑问.
【提出问题】废液中含有哪些物质?
【讨论交流】
①废液中一定含有的物质:碳酸钙、指示剂、水和NaCl;
②还含有能使废液呈碱性的物质.能使废液呈碱性的物质是什么?同学们有如下猜想:
猜想1:是碳酸钠;
猜想2:是氢氧化钠;
猜想3:是氢氧化钠和碳酸钠;
你的另一猜想是:氢氧化钙(写一种猜想).
【实验设计】用氯化钙溶液来验证上述猜想.
查阅资料获悉氯化钙溶液呈中性,并设计如下实验.请将实验设计补充完整.
| 实验内容 | 预计现象 | 预计结论 |
| 取少量废液钮中上层清液于试管中,加入过量氯化钙溶液,静置. | 猜想l正确 | |
| 没有白色沉淀,溶液呈红色 | 猜想2正确 | |
| 猜想3正确 |
14.2009年12月份的哥本哈根气候会议的议程中非常重要的一项就是如何有效控制温室效应,降低碳排放;在前不久召开的十一届全国人大三次会议上,各地人大代表也提出“低碳经济,低碳生活”,下列行为中你认为能减少碳排放的是( )
| A. | 开私家车出去春游 | |
| B. | 野炊时将垃圾和未使用完的柴火焚烧 | |
| C. | 使用太阳能热水器淋浴 | |
| D. | 使用纸巾代替手帕 |
15.比较、推理是化学学习中常用的思维方法.下列有关物质的比较、推理中正确的是( )
| A. | 酸能使石蕊溶液变红,CO2也能使石蕊溶液变红,所以CO2是一种酸 | |
| B. | NaCl和NaNO2都有咸味盐,故可用NaNO2代替NaCl作食用盐 | |
| C. | 金刚石和石墨都是碳的单质,石墨可作电极,所以金刚石也能作电极 | |
| D. | H2O和H2O2的分子构成不同,所以化学性质不同 |
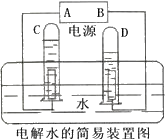 如图是电解水的简易装置.
如图是电解水的简易装置.
 已知A、B、C、D是初中化学常见的物质.它们之间的相互转化关系如图所示.其中A被看作是理想的“绿色能源”,B在常温下是一种无色液体,C可用于灭火.(部分反应物、生成物和反应条件未标出)请回答下列问题.
已知A、B、C、D是初中化学常见的物质.它们之间的相互转化关系如图所示.其中A被看作是理想的“绿色能源”,B在常温下是一种无色液体,C可用于灭火.(部分反应物、生成物和反应条件未标出)请回答下列问题.