题目内容
2. 实验室制取二氧化碳后,将废液过滤,得到含有氯化钙和稀盐酸的混合液,20℃
实验室制取二氧化碳后,将废液过滤,得到含有氯化钙和稀盐酸的混合液,20℃时,取混合液141.2g于烧杯中,向其中逐滴滴加溶质质量分数为10.6%的碳酸钠溶液,所产生的沉淀与所滴入碳酸钠溶液的质量关系如图所示.计算当滴入碳酸钠溶液至100g时,所得溶液中溶质质量分数.
分析 由图象可以看出产生沉淀前消耗50g碳酸钠溶液,这是与废液中盐酸反应的碳酸钠溶液的质量,由于盐酸反应的碳酸钠溶液的质量和质量分数,根据二者反应的化学方程式可以计算出生成氯化钠的质量.由图象中可知生成沉淀的质量,然后依据碳酸钠与氯化钙反应的化学方程式可以计算出生成氯化钠的质量.由两种反应生成的氯化钠的质量和除以所得溶液的质量就得到所得溶液中氯化钠的质量分数,所得溶液的质量应是反应的碳酸钠溶液总质量和混合液141.2g的和减去生成沉淀的质量和生成的二氧化碳的质量.
解答 解:设与盐酸反应时,生成氯化钠的质量为x,生成二氧化碳的质量为y.
Na2CO3+2HCl═2NaCl+CO2↑+H2O
106 117 44
50g×10.6% x y
$\frac{106}{50g×10.6%}=\frac{117}{x}=\frac{44}{y}$
x=5.85g,y=2.2g
设与氯化钙反应时,生成氯化钠的质量为w.
Na2CO3+CaCl2═CaCO3↓+2NaCl
100 117
5g w
$\frac{100}{5g}=\frac{117}{w}$
w=5.85g
所得溶液中氯化钠的质量分数为:$\frac{5.85g+5.85g}{141.2g+100g-2.2g-5g}×100%$=5%
答:所得溶液中氯化钠的质量分数为5%.
点评 本题主要考查含杂质物质的化学方程式计算和溶质质量分数的计算,增加了学生分析问题的思维跨度,考查了学生整合知识的能力,难度较大.

练习册系列答案
相关题目
12.如图是初中化学中实验室制取气体的两种基本装置和三种常用的收集方法,请比较装置A和装置B的差异:


| 装置A | 装置B | |
| 反应状态 | 固体反应生成气体 | 固体和液体反应生成气体 |
| 反应条件 | 加热 | 无需加热 |
13.体育课上同学们在做引体向上时常用“镁粉”搓手,以起到防滑效果.某种“镁粉”中可能含有Mg、MgO、Mg(OH)2、MgCO3中的一种或两种固体,实验小组对其成分展开了探究.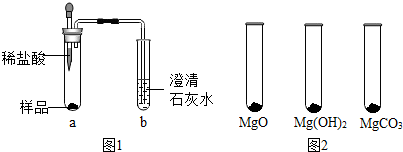
已知:MgO+2HCl═MgCl2+H2O MgCO3+2HCl═MgCl2+H2O+CO2↑
(1)探究“镁粉”中是否含有Mg和MgCO3.
①取少量样品,如图1所示进行实验,观察到a试管中有气泡产生,b试管中产生的现象是澄清石灰水变浑浊,则证明“镁粉”中一定含有MgCO3.
②为证明“镁粉”中是否含有Mg,小明将燃着的木条放在图中b试管口上方,木条熄灭,但同学们指出,该实验不能达成实验目的,需要将图中的澄清石灰水替换成浓NaOH溶液,目的是除掉二氧化碳.小明按照修改后的实验方案重复上述实验,观察到b试管口,证明“镁粉”中不含Mg.
(2)探究“镁粉”中是否还含有MgO及Mg(OH)2.
【实验过程】
Ⅰ.用MgO、Mg(OH)2和MgCO3三种固体分别做性质实验,分别取0.5g三种固体粉末,每次取样方法如图2所示:
逐滴加入相同溶质质量分数的稀盐酸直至粉末恰好消失,在下表中记录消耗的同浓度稀盐酸的体积(以下体积均在同一条件下测定,且保留到小数点后1位)
Mg(OH)2与盐酸发生中和反应的化学方程式为Mg(OH)2+2HCl═MgCl2+2H2O.
Ⅱ.取“镁粉”样品0.5g,加入上述稀盐酸至粉末恰好溶解,此时消耗稀盐酸的体积约为5.3mL.
【实验分析及结论】
“镁粉”不只含有MgCO3,理由是0.5gMgCO3消耗的盐酸体积与0.5g“镁粉”消耗的盐酸体积不相等.
【实验反思】
为确定“镁粉”的具体成分,同学们认为还需要补充如下实验:分别取0.5g“镁粉”和0.5gMgCO3,加入足量稀盐酸,测定生成的气体体积分别为119mL和140mL,由此可知“镁粉”中含有MgCO3的质量分数为85%,“镁粉”中除MgCO3外的另一种物质为Mg(OH)2.

已知:MgO+2HCl═MgCl2+H2O MgCO3+2HCl═MgCl2+H2O+CO2↑
(1)探究“镁粉”中是否含有Mg和MgCO3.
①取少量样品,如图1所示进行实验,观察到a试管中有气泡产生,b试管中产生的现象是澄清石灰水变浑浊,则证明“镁粉”中一定含有MgCO3.
②为证明“镁粉”中是否含有Mg,小明将燃着的木条放在图中b试管口上方,木条熄灭,但同学们指出,该实验不能达成实验目的,需要将图中的澄清石灰水替换成浓NaOH溶液,目的是除掉二氧化碳.小明按照修改后的实验方案重复上述实验,观察到b试管口,证明“镁粉”中不含Mg.
(2)探究“镁粉”中是否还含有MgO及Mg(OH)2.
【实验过程】
Ⅰ.用MgO、Mg(OH)2和MgCO3三种固体分别做性质实验,分别取0.5g三种固体粉末,每次取样方法如图2所示:
逐滴加入相同溶质质量分数的稀盐酸直至粉末恰好消失,在下表中记录消耗的同浓度稀盐酸的体积(以下体积均在同一条件下测定,且保留到小数点后1位)
| MgO | Mg(OH)2 | MgCO3 | |
| 消耗稀盐酸的体积/mL | 10.4 | 7.2 | 5.0 |
Ⅱ.取“镁粉”样品0.5g,加入上述稀盐酸至粉末恰好溶解,此时消耗稀盐酸的体积约为5.3mL.
【实验分析及结论】
“镁粉”不只含有MgCO3,理由是0.5gMgCO3消耗的盐酸体积与0.5g“镁粉”消耗的盐酸体积不相等.
【实验反思】
为确定“镁粉”的具体成分,同学们认为还需要补充如下实验:分别取0.5g“镁粉”和0.5gMgCO3,加入足量稀盐酸,测定生成的气体体积分别为119mL和140mL,由此可知“镁粉”中含有MgCO3的质量分数为85%,“镁粉”中除MgCO3外的另一种物质为Mg(OH)2.
14.下列生活中常见的变化中,属于物理变化的是( )
| A. | 米饭变馊 | B. | 木柴燃烧 | C. | 瓷碗破碎 | D. | 玉米酿酒 |
12.可以用固体NaOH干燥的一组气体是( )
| A. | HCl和CO2 | B. | O2和CO | C. | CO2和O2 | D. | HCl和H2 |