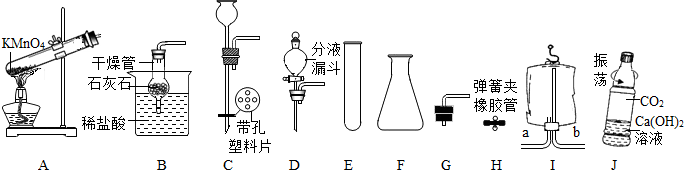
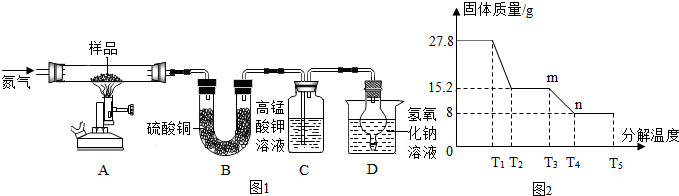
题目内容
3.下列各组粒子中,核外电子数不相等的是( )| A. | NH4+和F- | B. | H3O+和CH4 | C. | O2-和Mg2+ | D. | Na+和 Cl- |
分析 根据微粒的质子数和微粒的电荷数来分析微粒的核外电子数的关系,利用阳离子中的核外电子数为质子数之和减去电荷数,阴离子中的核外电子数为质子数之和加上微粒的电荷数来解答.
解答 解:A、NH4+中的核外电子数为7+1×4-1=10,F-中的核外电子数为9+1=10,则核外电子数相等,故A错误;
B、H3O+中的核外电子数为1×3+8-1=10,CH4中的核外电子数为6+1×4=10,则核外电子数相等,故B错误;
C、O2-中的核外电子数为8+2=10,Mg2+中的核外电子数为12-2=10,则核外电子数相等,故C错误;
D、Na+中的核外电子数为11-1=10,Cl-中的核外电子数为18,则核外电子数不相等,故D正确;
故选D.
点评 本题考查微粒的核外电子数的分析,明确原子的质子数及微粒中的质子数与带电荷数的关系是解答的关键.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
13.下列图象能正确反映对应变化关系的是( )
| A. |  在一定质量的硝酸钾不饱和溶液中加入硝酸钾固体 | |
| B. |  将等质量的锌粉和铁粉中分别加入等质量分数的稀盐酸 | |
| C. |  在氢氧化钠和碳酸钠的混合溶液中加入稀盐酸 | |
| D. |  加热一定量的高锰酸钾固体 |
11.逻辑推理是一种重要的化学思维方法,以下推理合理的是( )
| A. | 因为水结冰时质量没有发生改变,所以该变化遵循质量守恒定律 | |
| B. | 因为蜡烛燃烧生成CO2和H2O,所以蜡烛的组成里一定含有碳、氢、氧元素 | |
| C. | 因为化学变化都遵循质量守恒定律,所以质量不发生改变的变化一定是化学变化 | |
| D. | 因为H2和CH4的组成中都含有氢元素,所以它们的燃烧产物中都含有水 |
18.对比、分析下列化学反应,并完成相关问题.
| 组别 | 化学方程式 | 问题 |
| Ⅰ | 2KMnO4$\frac{\underline{\;\;△\;\;}}{\;}$K2MnO4+MnO2+O2↑ 高锰酸钾 2KClO3$\frac{\underline{MnO_2}}{△}$2KCl+3O2 | 比较两个化学方程式,在实验室中都可以用来制取氧气,你的判断依据是 高锰酸钾和氯酸钾中都含有氧元素. |
| Ⅱ | ①写出铁丝燃烧的化学方程式: 3Fe+2O2$\frac{\underline{\;点燃\;}}{\;}$Fe3O4 ②写出氢气燃烧的化学方程式: 2H2+O2$\frac{\underline{\;点燃\;}}{\;}$2H2O | 比较两个化学方程式,指出它们的共同点: ① 都是化合反应; ② 反应条件都是点燃; ③ 都是氧化反应. |
| Ⅲ | ①写出实验室用过氧化氢溶液制取氧气的化学方程式: 2H2O2$\frac{\underline{\;MnO_2\;}}{\;}$2H2O+O2↑; ②写出电解水实验的化学方程式: 2H2O$\frac{\underline{\;通电\;}}{\;}$2H2↑+O2↑. | 比较两个化学方程式,都能产生氧气,若产生等质量的氧气,则需要水和过氧化氢的质量比是 9:17,过氧化氢和水的组成元素 相同,(填“相同”或“不同”,下同)但是化学性质 不同,是因为构成物质的分子结构不同. |
12. 砷化镓(GaAs)是一种“LED”绿色节能光源材料,镓元素的相关信息如图.下列有关镓的说法正确的是( )
砷化镓(GaAs)是一种“LED”绿色节能光源材料,镓元素的相关信息如图.下列有关镓的说法正确的是( )
 砷化镓(GaAs)是一种“LED”绿色节能光源材料,镓元素的相关信息如图.下列有关镓的说法正确的是( )
砷化镓(GaAs)是一种“LED”绿色节能光源材料,镓元素的相关信息如图.下列有关镓的说法正确的是( )| A. | 属于非金属元素 | B. | 原子的核内质子数是31 | ||
| C. | 原子的核内中子数是31 | D. | 1个镓原子的质量为69.72g |