题目内容
6.某化工厂为综合利用硫酸亚铁,设计了以下工艺流程.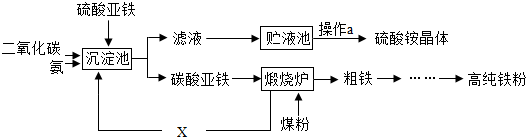
(1)煅烧炉中碳酸亚铁首先分解成氧化亚铁和二氧化碳,然后煤粉把二氧化碳还原为一氧化碳.一氧化碳的作用是将铁从氧化亚铁中还原出来.写出发挥该作用时发生的化学反应方程式FeO+CO$\frac{\underline{\;高温\;}}{\;}$Fe+CO2.
(2)循环利用X的优点是减少温室气体CO2的排放(或降低生产成本).
(3)请设计实验证明硫酸铵是铵态氮肥.
| 实验步骤 | 实验现象 | 实验结论 |
| 样品为铵态氮肥 |
分析 (1)根据一氧化碳具有还原性,能将金属氧化物还原为金属单质来分析;
(2)根据实验流程图可知,X是二氧化碳;
(3)根据铵根离子的检验方法来分析.
解答 解:(1)一氧化碳具有还原性,在高温的条件下能将氧化亚铁还原为铁和二氧化碳;故填:将铁从氧化亚铁中还原出来;FeO+CO$\frac{\underline{\;高温\;}}{\;}$ Fe+CO2
(2)X是碳酸亚铁分解生成的二氧化碳,二氧化碳重新利用,可以减少温室气体的排放,降低温室效应;故填:减少温室气体CO2的排放(或降低生产成本)(合理均对);
(3)由于铵盐遇碱会生成氨气,所以可设计硫酸铵与消石灰共同研磨,从产生刺激性气味分析设计;
故答案为:
| 实验步骤 | 实验现象 | 实验结论 |
| 取适量样品,放在研钵中,加入 少量消石灰,混合研磨,用湿润的红色石蕊试纸检测产生的气体 | 产生刺激性的氨臭味气体,试纸变蓝 | 样品为铵态氮肥 |
点评 本题考查了物质的制备,解答时,根据流程图结合反应的原理来分析解答.

练习册系列答案
相关题目
10.以下说法正确的是( )
| A. | 常温下金属都是固体 | |
| B. | 青铜的硬度比铜小 | |
| C. | 青铜、生铁、焊锡均属合金 | |
| D. | 炼铁的主要原料有铁矿石、焦炭、生石灰 |
11.下列各种铜矿石的主要成分中,含元素种类最多的是( )
| A. | 赤铜矿(Cu2O) | B. | 辉铜矿(Cu2S) | C. | 斑铜矿(Cu3FeS4) | D. | 孔雀石[Cu2(OH)2CO3] |
11.盐酸和硫酸是常见的酸,某化学学习小组探究了它们的一些性质.
(1)用稀硫酸和盐酸均可以去除铁锈(主要成分为Fe2O3).某化学兴趣小组为探究哪种微粒能使氧化铁溶解,设计了如下实验方案,并得出初步结论.
①填写下表中的实验结论.
②同学们认为不需要做“向Fe2O3中加入水”的对比实验,其中的理由是什么?
(2)同学们把如图1甲、乙所示实验完成后,依次将废液缓慢倒入同一洁净的烧杯中.当倾倒液体时,观察到废液中有气泡产生.
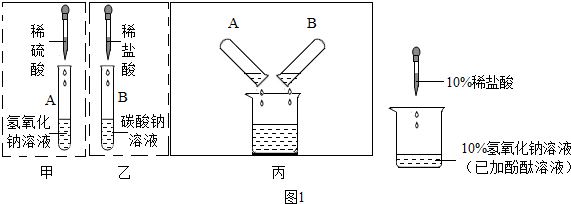
①经讨论确定,A试管中废液里的溶质是Na2SO4、H2SO4(写化学式,下同);B试管中废液里的溶质是NaCl、Na2CO3.
②在丙所示实验过程中有气体产生,请写出此反应的化学方程式.
(3)盐酸与氢氧化钠反应放热,如图2(左)所示为二者溶液混合的探究实验.随着盐酸的不断滴入,烧杯中溶液温度的变化如图2所示.
①b点时如图呈酸性(填“酸性”、“碱性”或“中性”).
②当溶液温度为38℃时,可证明溶液中氢氧化钠已经不存在的实验现象是什么?
(4)称取铜、锌混合物粉末10g置于烧杯中,慢慢加入稀硫酸使其充分反应,直至固体质量不再减少为止,此时用去49g稀硫酸,且烧杯中剩余固体的质量为3.5g.请计算:所用的稀硫酸中溶质的质量分数是多少?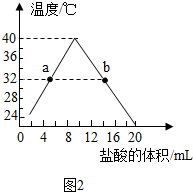
(1)用稀硫酸和盐酸均可以去除铁锈(主要成分为Fe2O3).某化学兴趣小组为探究哪种微粒能使氧化铁溶解,设计了如下实验方案,并得出初步结论.
①填写下表中的实验结论.
| 实验过程 | 实验现象 | 实验结论 |
| 向盛有少量Fe2CO3的试管中分别加入NaCl溶液和Na2SO4溶液,振荡 | 固体不溶解 | ${SO}_{4}^{2-}$或Cl-不能使Fe2O3溶解;H2O分子不能使Fe2O3溶解 |
(2)同学们把如图1甲、乙所示实验完成后,依次将废液缓慢倒入同一洁净的烧杯中.当倾倒液体时,观察到废液中有气泡产生.

①经讨论确定,A试管中废液里的溶质是Na2SO4、H2SO4(写化学式,下同);B试管中废液里的溶质是NaCl、Na2CO3.
②在丙所示实验过程中有气体产生,请写出此反应的化学方程式.
(3)盐酸与氢氧化钠反应放热,如图2(左)所示为二者溶液混合的探究实验.随着盐酸的不断滴入,烧杯中溶液温度的变化如图2所示.
①b点时如图呈酸性(填“酸性”、“碱性”或“中性”).
②当溶液温度为38℃时,可证明溶液中氢氧化钠已经不存在的实验现象是什么?
(4)称取铜、锌混合物粉末10g置于烧杯中,慢慢加入稀硫酸使其充分反应,直至固体质量不再减少为止,此时用去49g稀硫酸,且烧杯中剩余固体的质量为3.5g.请计算:所用的稀硫酸中溶质的质量分数是多少?

16.金属和酸溶液反应,不能生成的物质是( )
| A. | FeCl3 | B. | MgCl2 | C. | Al2(SO4)3 | D. | ZnSO4 |

