题目内容
11.人们的日常生活离不开金属,高科技新材料的开发和应用也需要金属.硅钢可用于制造变压器的铁芯,某化学兴趣小组的同学为了验证硅钢(主要含有Fe、C、Si),设计了如图的实验流程(有些反应的部分反应物和生成物已省略).
查阅资料发现:常温下,单质硅(Si)不能与盐酸反应,但能与氢氧化钠溶液反应(Si+2NaOH+H2O═Na2SiO3+2H2↑).
根据以上信息,回答下列问题:
(1)固体A的成分为碳、硅,E的化学式为Fe2O3;
(2)滤液B中的金属阳离子为Fe2+;
(3)在过滤操作时,若发现滤液浑浊,应查找原因,处理后重新过滤;
(4)步骤⑤中发生的是化合反应,尝试写出其化学方程式4Fe(OH)2+O2+2H2O=4Fe(OH)3.
分析 根据硅钢中的铁和盐酸反应会生成氯化亚铁和氢气,所以滤液B是氯化亚铁,固体A中含有碳、硅,硅和氢氧化钠溶液反应会生成硅酸钠和氢气,所以黑色固体D是碳,氢氧化铁加热生成氧化铁和水,所以E是氧化铁,氧化铁和碳在高温的条件下生成铁和二氧化碳,然后将推出的物质进行验证即可.
解答 解:(1)硅钢中的铁和盐酸反应会生成氯化亚铁和氢气,所以滤液B是氯化亚铁,固体A中含有碳、硅,硅和氢氧化钠溶液反应会生成硅酸钠和氢气,所以黑色固体D是碳,氢氧化铁加热生成氧化铁和水,所以E是氧化铁,氧化铁和碳在高温的条件下生成铁和二氧化碳,经过验证,推导正确,所以A是碳、硅,
E的化学式为:Fe2O3;
(2)硅钢中主要含有Fe、C、Si,只有Fe能与稀盐酸反应生成氯化亚铁,所以剩余的固体A的成分中含有C、Si,滤液B中的金属阳离子为Fe2+;
(3)在过滤操作时,若发现滤液浑浊,应查找原因,处理后重新过滤;
(4)步骤⑤中发生的是化合反应中,反应物是Fe(OH)2与氧气和水,生成物是氢氧化铁,化学方程式是:4Fe(OH)2+O2+2H2O=4Fe(OH)3.
故答案为:(1)碳、硅,Fe2O3;
(2)Fe2+;
(3)查找原因,处理后重新过滤;
(4)4Fe(OH)2+O2+2H2O=4Fe(OH)3.
点评 解答本题关键是要知道回收金属时,是利用排在盐中金属元素前面的金属把盐中的金属元素置换出来,为了反应完全,要加入过量的金属,固体中会混有置换出来的金属和过量的金属,再利用二者性质的不同进行分离.

练习册系列答案
相关题目
9.在我们的日常生活中涉及到许多变化,下列变化中不包含化学变化的是( )
| A. | 用石灰浆涂抹墙壁后,表面有水珠生成 | |
| B. | 在口中咀嚼米饭或馒头时感到有甜味 | |
| C. | 用干冰做制冷剂进行人工降雨 | |
| D. | 使用煤气作燃料烧饭做菜 |
2.某化学兴趣小组围绕“酸碱中和反应”,在老师引导下开展探究活动.
探究Ⅰ:证明氢氧化钠溶液与稀盐酸确实能发生反应.
【方案1】测定稀盐酸与NaOH溶液混合前后的pH.
测定某NaOH溶液的pH,pH大于7.将一定量的稀盐酸加入该NaOH溶液中,混合均匀后测定其pH,发现pH减小了,但仍然大于7,小组中有的同学认为根据这个测定结果可以认为稀盐酸与NaOH溶液发生了反应,你认为他们的结论是否正确:不正确,理由滴加的盐酸中含水,加入后使NaOH溶液变稀,同样会使溶液碱性减弱,pH减小.经过讨论后,他们向溶液中又加入一定量的稀盐酸,混合均匀后测定其pH,pH小于7.
结论:稀盐酸与氢氧化钠溶液发生了化学反应,并且稀盐酸过量.
【方案2】借助于无色酚酞试液.
【药品仪器】(如图1)
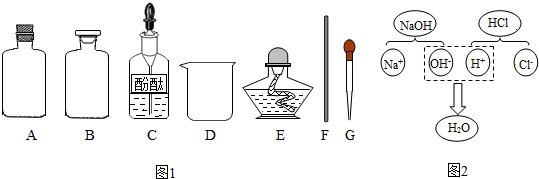
①取A(选填“A”或“B”)中试剂加入至D中,滴加2滴酚酞试液,溶液呈红色;
②用胶头滴管向①中溶液滴加稀盐酸,红色消失;
③用F蘸取②中溶液,在酒精灯上灼烧,有白色固体产生.
【思考拓展】
(1)如不使用酸碱指示剂,进一步确认步骤③中的白色固体不是氢氧化钠的方法是:取②中溶液,向其中滴加硫酸铜溶液,无蓝色沉淀
(2)探究步骤②中无色溶液中稀盐酸是否过量.
根据上述反应过程中溶液变成无色,不能确定稀盐酸是否过量,兴趣小组同学又分别选取了AgNO3溶液、紫色石蕊试液、铁粉设计实验方案,请你分析并判断:
方案③中反应的化学方程式Fe+2HCl=FeCl2+H2↑.上述设计方案中,不正确的是①(填“①”、
“②”或“③”),错误的原因是氯化钠溶液中也含Cl-,与硝酸银溶液反应也会生成白色沉淀.
请你再设计一个与上述实验不同原理的方案以确定稀盐酸是否过量,你选用的试剂是加入氧化铜或碳酸钠溶液.
(3)探究Ⅱ:从微观的角度认识物质及其变化的本质.图2表示氢氧化钠溶液与盐酸反应的微观过程,该反应的本质是H+、OH-结合生成水.
探究Ⅰ:证明氢氧化钠溶液与稀盐酸确实能发生反应.
【方案1】测定稀盐酸与NaOH溶液混合前后的pH.
测定某NaOH溶液的pH,pH大于7.将一定量的稀盐酸加入该NaOH溶液中,混合均匀后测定其pH,发现pH减小了,但仍然大于7,小组中有的同学认为根据这个测定结果可以认为稀盐酸与NaOH溶液发生了反应,你认为他们的结论是否正确:不正确,理由滴加的盐酸中含水,加入后使NaOH溶液变稀,同样会使溶液碱性减弱,pH减小.经过讨论后,他们向溶液中又加入一定量的稀盐酸,混合均匀后测定其pH,pH小于7.
结论:稀盐酸与氢氧化钠溶液发生了化学反应,并且稀盐酸过量.
【方案2】借助于无色酚酞试液.
【药品仪器】(如图1)

①取A(选填“A”或“B”)中试剂加入至D中,滴加2滴酚酞试液,溶液呈红色;
②用胶头滴管向①中溶液滴加稀盐酸,红色消失;
③用F蘸取②中溶液,在酒精灯上灼烧,有白色固体产生.
【思考拓展】
(1)如不使用酸碱指示剂,进一步确认步骤③中的白色固体不是氢氧化钠的方法是:取②中溶液,向其中滴加硫酸铜溶液,无蓝色沉淀
(2)探究步骤②中无色溶液中稀盐酸是否过量.
根据上述反应过程中溶液变成无色,不能确定稀盐酸是否过量,兴趣小组同学又分别选取了AgNO3溶液、紫色石蕊试液、铁粉设计实验方案,请你分析并判断:
| 实验方案 | 实验步骤 | 现 象 | 结 论 |
| ① | 取样,加入适量的AgNO3溶液 | 出现白色沉淀 | 稀盐酸过量 |
| ② | 取样,加入几滴紫色石蕊试液 | 溶液变红 | 稀盐酸过量 |
| ③ | 取样,加入少量铁粉 | 黑色固体溶解,产生气泡,溶液变浅绿色 | 稀盐酸过量 |
“②”或“③”),错误的原因是氯化钠溶液中也含Cl-,与硝酸银溶液反应也会生成白色沉淀.
请你再设计一个与上述实验不同原理的方案以确定稀盐酸是否过量,你选用的试剂是加入氧化铜或碳酸钠溶液.
(3)探究Ⅱ:从微观的角度认识物质及其变化的本质.图2表示氢氧化钠溶液与盐酸反应的微观过程,该反应的本质是H+、OH-结合生成水.
6.人类应合理利用和开发金属资源.
(1)用铜丝做电线是利用了铜的导电性;高压电线一般用铝而不用铜的主要原因是铜的价格比铝高,且密度比较大.
(2)铁是化学性质比较活泼的金属,它在自然界中主要以化合物(填“单质”或“化合物”)的形式存在;在钢铁表面涂油、喷漆、镀铬等,都能防止钢铁生锈.
(3)高炉炼铁的主要反应原理是用一氧化碳还原氧化铁,反应的化学方程式为Fe2O3+3CO$\frac{\underline{\;高温\;}}{\;}$2Fe+3CO2.
(4)为了探究影响锌与稀硫酸反应剧烈程度的因素,某学习小组用相同的三块锌片进行了以下实验.
对比实验①和②,其目的是探究温度对该反应剧烈程度的影响,则对比实验①和③,目的是探究温度对该反应剧烈程度的影响.
(5)欲验证铝、铁、铜三种金属的活动顺序,若是提供铝丝和铜丝,还需要选择的一种盐溶液是硫酸亚铁溶液.
(1)用铜丝做电线是利用了铜的导电性;高压电线一般用铝而不用铜的主要原因是铜的价格比铝高,且密度比较大.
(2)铁是化学性质比较活泼的金属,它在自然界中主要以化合物(填“单质”或“化合物”)的形式存在;在钢铁表面涂油、喷漆、镀铬等,都能防止钢铁生锈.
(3)高炉炼铁的主要反应原理是用一氧化碳还原氧化铁,反应的化学方程式为Fe2O3+3CO$\frac{\underline{\;高温\;}}{\;}$2Fe+3CO2.
(4)为了探究影响锌与稀硫酸反应剧烈程度的因素,某学习小组用相同的三块锌片进行了以下实验.
| 实验① | 实验② | 实验③ |
 |  |  |
(5)欲验证铝、铁、铜三种金属的活动顺序,若是提供铝丝和铜丝,还需要选择的一种盐溶液是硫酸亚铁溶液.
16.硼氢化钠(NaBH4,其中氢元素的化合价为-1)是一种安全车载氢源.有关硼氢化钠的说法正确的是( )
| A. | 含2个氢分子 | B. | 硼元素的化合价为+3 | ||
| C. | 只含一种非金属元素 | D. | Na、B、H的质量比为1:1:4 |
20. 食醋是厨房中常用的调味品,它的主要成分是乙酸,乙酸分子的模型如图所示,其中
食醋是厨房中常用的调味品,它的主要成分是乙酸,乙酸分子的模型如图所示,其中 代表一个碳原子,○代表一个氢原子,
代表一个碳原子,○代表一个氢原子, 代表一个氧原子,下列说法不正确的是( )
代表一个氧原子,下列说法不正确的是( )
 食醋是厨房中常用的调味品,它的主要成分是乙酸,乙酸分子的模型如图所示,其中
食醋是厨房中常用的调味品,它的主要成分是乙酸,乙酸分子的模型如图所示,其中 代表一个碳原子,○代表一个氢原子,
代表一个碳原子,○代表一个氢原子, 代表一个氧原子,下列说法不正确的是( )
代表一个氧原子,下列说法不正确的是( )| A. | 乙酸是一种化合物 | |
| B. | 乙酸的相对分子质量为60 | |
| C. | 乙酸中碳元素的质量分数为60% | |
| D. | 乙酸分子中的碳原子、氢原子、氧原子的个数比为1:2:1 |
1.下列四个实验中只需要完成三个就可以证明Zn、Cu、Ag三种金属的活动性顺序,其中不必进行的实验是( )
| A. | 将锌片放入稀硫酸 | B. | 将铜片放入稀硫酸 | ||
| C. | 将铜片放入硝酸银溶液 | D. | 将锌片放入硝酸银溶液 |
 构建知识网络可以增加我们对物质化学性质的认识.如图是某同学构建的初中常见物质之间的知识网络.A、B、C、D、E是初中化学常见的不同类别的物质.它们之间有如图所示的转化和反应关系(“→”表示一种物质经一步反应可转化为另一种物质,“-”表示相连两物质能发生化学反应,部分反应物、生成物及反应条件已略去)
构建知识网络可以增加我们对物质化学性质的认识.如图是某同学构建的初中常见物质之间的知识网络.A、B、C、D、E是初中化学常见的不同类别的物质.它们之间有如图所示的转化和反应关系(“→”表示一种物质经一步反应可转化为另一种物质,“-”表示相连两物质能发生化学反应,部分反应物、生成物及反应条件已略去)