题目内容
8. A、B、C、D、X、Y、Z是初中化学常见的物质,相互关系如图所示.“→”表示转化关系,“-”表示相互之间能反应(部分反应物、生成物及反应条件省略).其中,X是应用最广泛的金属;Y可用作食品干燥剂;C溶液呈蓝色,可用于配制农药波尔多液;B、D所属物质类别相同,D俗称烧碱.请回答下列问题:
A、B、C、D、X、Y、Z是初中化学常见的物质,相互关系如图所示.“→”表示转化关系,“-”表示相互之间能反应(部分反应物、生成物及反应条件省略).其中,X是应用最广泛的金属;Y可用作食品干燥剂;C溶液呈蓝色,可用于配制农药波尔多液;B、D所属物质类别相同,D俗称烧碱.请回答下列问题:(1)X的化学式:Fe;D的化学式是NaOH.
(2)反应①属于放热(填“放热”或“吸热”),②若Z为CO2,则反应②的现象为有白色沉淀生成.
(3)写出下列反应的化学方程式:
X与CFe+CuSO4=FeSO4+Cu;
A与BH2SO4+Ca(OH)2=CaSO4+2H2O;
C与DCuSO4+2NaOH=Cu(OH)2↓+Na2SO4.
分析 根据A、B、C、D、X、Y、Z是初中化学常见的物质,X是应用最广泛的金属,所以X是铁,Y可用作食品干燥剂,所以Y是氧化钙,C溶液呈蓝色,可用于配制农药波尔多液,所以C是硫酸铜,B、D所属物质类别相同,D俗称烧碱,所以D是氢氧化钠,氧化钙会转化成B,所以B是氢氧化钙,A会转化成硫酸铜,会与氧化钙、氢氧化钙反应,所以A是硫酸,Z会与氢氧化钠、氢氧化钙反应,所以可以Z是二氧化碳,X会与硫酸、硫酸铜反应,所以X可以是铁,然后将推出的物质进行验证即可.
解答 解:(1)A、B、C、D、X、Y、Z是初中化学常见的物质,X是应用最广泛的金属,所以X是铁,Y可用作食品干燥剂,所以Y是氧化钙,C溶液呈蓝色,可用于配制农药波尔多液,所以C是硫酸铜,B、D所属物质类别相同,D俗称烧碱,所以D是氢氧化钠,氧化钙会转化成B,所以B是氢氧化钙,A会转化成硫酸铜,会与氧化钙、氢氧化钙反应,所以A是硫酸,Z会与氢氧化钠、氢氧化钙反应,所以可以Z是二氧化碳,X会与硫酸、硫酸铜反应,所以X可以是铁,经过验证,推导正确,所以X是Fe,D是NaOH;
(2)反应①是氧化钙和水反应生成氢氧化钙,属于放热,②若Z为CO2,则反应②是氢氧化钙和二氧化碳反应生成碳酸钙沉淀和水,实验现象为有白色沉淀生成;
(3)X与C的反应是铁和硫酸铜反应生成硫酸亚铁和铜,化学方程式为:Fe+CuSO4=FeSO4+Cu;
A与B是硫酸和氢氧化钙反应生成硫酸钙和水,化学方程式为:H2SO4+Ca(OH)2=CaSO4+2H2O;
C与D是硫酸铜和氢氧化钠反应生成氢氧化铜沉淀和硫酸钠,化学方程式为:CuSO4+2NaOH=Cu(OH)2↓+Na2SO4.
故答案为:(1)Fe,NaOH;
(2)放热,有白色沉淀生成;
(3)Fe+CuSO4=FeSO4+Cu;
H2SO4+Ca(OH)2=CaSO4+2H2O;
CuSO4+2NaOH=Cu(OH)2↓+Na2SO4.
点评 在解此类题时,首先将题中有特征的物质推出,然后结合推出的物质和题中的转化关系推导剩余的物质,最后将推出的各种物质代入转化关系中进行验证即可.

| A. | 溶液一定是无色的 | B. | 溶剂一定是水 | ||
| C. | 溶液中一定只含有一种溶质 | D. | 溶液一定是混合物 |
| A. | 向某固体中加入稀盐酸,产生无色气体,则原固体中一定含CO32- | |
| B. | 汗水浸湿的衣服晾干后出现白色斑迹,是因为水分蒸发后盐分结晶析出 | |
| C. | 氨水是氨气的水溶液,根据气体溶解度变化规律,贮存时要阴凉密封 | |
| D. | 氯化钠在20℃时溶解度是36g,则20℃时的136g的氯化钠饱和溶液中含有氯化钠36g |
| A. |  集气验满 | B. |  液体加热 | C. |  读液体的体积 | D. |  稀释浓硫酸 |
【药品器材】水、氯化铵、氯化钙、氯化钠;烧杯、药匙、玻璃棒、量筒、温度计等.
【实验探究】三种物质各取1药匙于烧杯分别溶于水,另还有一个烧杯只加水,用温度计测量液体温度,并记录有关数据如下:
| 实验 | 水的体积 | 所加物质 | 测量液体温度(℃) |
| 实验1 | 50mL | 氯化铵 | 15 |
| 实验2 | 50mL | 氯化钙 | 28 |
| 实验3 | X | 氯化钠 | 21 |
| 实验4 | 50mL | 无 | 22 |
(1)表中X为50mL.
(2)比较实验2与实验4,可获得的结论是氯化钙溶解过程中放热.
(3)如果要生产一种“冰袋”用于冷敷,上述三种物质中最合适的是NH4Cl.
【反思评价】
(4)经讨论认为本实验操作中存在缺陷,它是AB(填选项,可多选).
A.实验操作过程没有采取较为严格的保温措施
B.加入物质的质量可能不相等
C.加入物质的种类不一样.
| A. | CO2+H2O+CaCl2═2HCl+CaCO3↓ | B. | 2NaCl+MgSO4═Na2SO4+MgCl2 | ||
| C. | 2HgO═2Hg+O2 | D. | 2KOH+CO2═K2CO3+H2O |
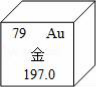 如图是金元素在元素周期表中的信息示意图.从图中获取的信息正确的是A.
如图是金元素在元素周期表中的信息示意图.从图中获取的信息正确的是A.