题目内容
7.某化学兴趣小组想通过提纯含有Na2SO4杂质的NaCl样品,再用提纯得到的NaCl固体配制出150克16%的NaCl溶液.以下是除去NaCl样品中少量Na2SO4的流程: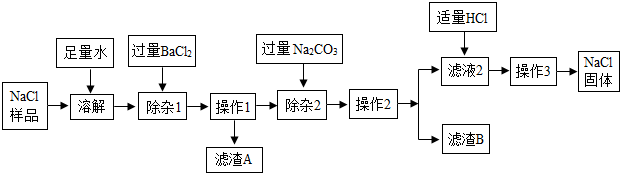
(1)NaCl样品提纯
①溶解中,向NaCl样品中加入足量水,用玻璃棒进行搅拌,目的是搅拌,加速溶解.
②除杂1中,BaCl2溶液与杂质Na2SO4发生反应的化学方程式是BaCl2+Na2SO4=BaSO4↓+2NaCl.
③除杂2中,加入“过量Na2CO3”的目的是除去杂质离子Ba2+(填离子符号).
④加入适量HCl前,滤液2中存在的溶质是NaCl、Na2CO3.在装有滤液2的烧杯中,加入适量HCl的操作方法是向滤液中滴加适量稀盐酸,至恰好无气泡产生.
⑤操作3中,将滤液2放在蒸发皿中蒸发,当蒸发皿中出现较多固体时,停止加热.
(2)实验室现在要配制150g质量分数为16%的NaCl溶液.配制时,涉及以下实验步骤:
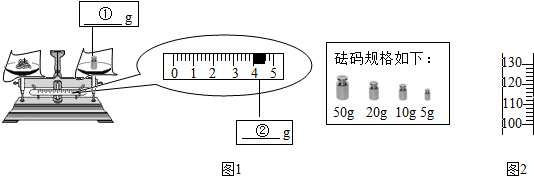
①称量NaCl固体的质量:在图1中分别标出所选砝码①的质量和游码②的示数.
②量取水的体积(水的密度为1g/mL),请在图2标出所需水的体积示数.
分析 (1)①据溶解时玻璃棒的作用解答;
②根据氯化钡与硫酸钠反应原理书写方程式;
③据碳酸钠可与氯化钡反应分析解答;
④据反应流程图分析滤液成分;加入稀盐酸是为了除去滤液中过量的碳酸钠,所以可据加入盐酸时溶液中是否有气泡产生,判断碳酸钠是否被除尽;
⑤蒸发时当蒸发皿中有较多固体出现时即可停止加热,用蒸发皿的余热蒸干;
(2)①根据溶质质量=溶液质量×溶质的质量分数,计算出所需氯化钠固体的质量,进而确定所选砝码的质量和游码的示数;
②溶剂质量=溶液质量-溶质质量,据此进行分析解答.
解答 解:(1)该实验流程是:加入水溶解形成硫酸钠、氯化钠的混合液,然后加入过量氯化钡除去硫酸钠,过滤得到滤液1,其成分是氯化钠、和过量的氯化钡,加入过量碳酸钠除去滤液中的氯化钡,过滤得到滤液2,其中含有生成的氯化钠和原来就有的氯化钠,及过量的碳酸钠,再加入适量的盐酸将过量的碳酸钠反应掉,得到氯化钠溶液,再加热蒸发即可得纯净的氯化钠固体;
①溶解中,向NaCl样品中加入足量水,用玻璃棒进行搅拌,目的是搅拌,加速固体.
②除杂1中,BaCl2溶液与杂质Na2SO4发生反应成硫酸钡沉淀和氯化钠,反应的化学方程式是BaCl2+Na2SO4=BaSO4↓+2NaCl.
③由上述分析可知:除杂2中,加入“过量Na2CO3”的目的是除去加入的过量的氯化钡,将钡离子形成沉淀反应掉,其离子符号是Ba2+;
④由上述分析可知:加入适量HCl前,滤液2中存在的溶质是过量的碳酸钠和氯化钠.在装有滤液2的烧杯中,加入适量HCl的操作方法是:向滤液中滴加适量稀盐酸,至恰好无气泡产生.
⑤操作3中,将滤液2放在蒸发皿中蒸发,当蒸发皿中 出现较多固体时,停止加热,用蒸发皿的余热蒸干.
(2)实验室现在要配制150g质量分数为16%的NaCl溶液.
①溶质质量=溶液质量×溶质的质量分数,配制150g质量分数为16%的NaCl溶液,所需NaCl固体的质量为150g×16%=24g;选用20g的砝码,游码拨到4g处即可.见下图;
②需要水的质量是150g-24g=126g,即124mL,读数时视线与凹液面的最低处相平,见下图;
故答案为:(1)①搅拌,加速溶解;
②BaCl2+Na2SO4=BaSO4↓+2NaCl;
③Ba2+;
④NaCl、Na2CO3;向滤液中滴加适量稀盐酸,至恰好无气泡产生;
⑤出现较多固体;
(2)
点评 本题主要考了在粗盐提纯的试验中对杂质进行转换的探究,除去杂质的同时不能引入新的杂质,并明确溶质的质量分数计算等相关知识,综合性较强.

【查阅资料】
| 20℃ | 8%Na2CO3溶液 | 8%NaHCO3溶液 |
| pH | 10.6 | 8.0 |
| 溶解度 | 10℃ | 20℃ | 30℃ | 40℃ |
| Na2CO3 | 12.5g | 21.5g | 39.7g | 49.0g |
| NaHCO3 | 8.1g | 9.6g | 11.1g | 12.7g |
Ⅰ.NaHCO3和Na2CO3性质差异的探究
(1)现有20℃时溶质质量分数为8%的Na2CO3和NaHCO3溶液
酸碱性:取样于试管中,分别滴加紫色石蕊试液,均显红色;
酸碱度:NaHCO3溶液<Na2CO3溶液(填“>”或”“<”).
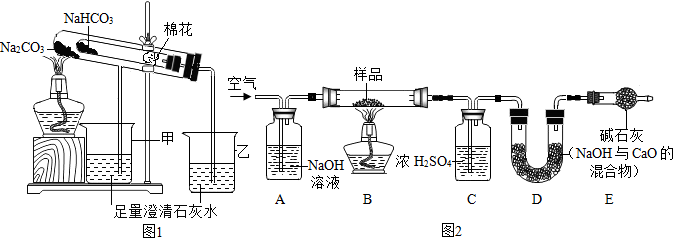
(2)稳定性:按图1,实验中可观察乙烧杯中的石灰水变浑浊,对应试管中发生反应的化学方程式为:CO2+Ca(OH)2═CaCO3↓+H2O.
结论:在受热条件下,碳酸钠比碳酸氢钠稳定性强(填“强”或“弱”).
(3)利用溶解度鉴别NaHCO3和Na2CO3:分别取Xg两种固体粉末加入20℃,10g水中充分溶解,通过观察溶解现象来区分,X可以是下列的A.(选填A、B或C)
A.2g B.0.96g C.0.5g
Ⅱ.测定NaHCO3和Na2CO3混合物10.0g中NaHCO3的质量分数(图2,夹持装置略)
【问题讨论】
(4)实验前先通一段时间的空气的目的是排尽装置内的空气(或二氧化碳);
(5)A的作用是吸收鼓入空气中的二氧化碳,若没有装置E,NaHCO3的质量分数测定结果会偏大(填“偏大”、“不变”或“偏小”).
(6)停止加热后,仍继续通入空气一段时间,目的是使反应生成的二氧化碳全部被D吸收.
【含量测定】
(7)测得装置D的质量实验前为120.2g,实验后为122.4g,计算该样品中NaHCO3的质量分数.(要有计算过程)
【知识拓展】
(8)向Na2CO3溶液中通入CO2气体可以生成NaHCO3,该反应的化学反应方程式为:Na2CO3+CO2+H2O═2NaHCO3.

| A. | ①在化合物中的化合价通常为+1 价 | B. | ②的化学性质比较稳定 | ||
| C. | ③是一种阳离子 | D. | ④容易得到电子 |
| A. |  熄灭酒精灯 | B. |  倾倒液体 | C. |  称量固体 称量固体 | D. |  过滤 |
| A. | CuO+2HCl=CuCl2+H2O | B. | BaCl2+H2SO4=BaSO4↓+2HCl | ||
| C. | Ca(OH)2+2HNO3=Ca(NO3)2+2H2O | D. | 2NaOH+CO2=Na2CO3+H2O |
| A. | 2Na+中“2”表示钠离子的个数是2 | |
| B. | H2中“2”表示每个氢分子中含有2个氢原子 | |
| C. | 2 H2表示2个氢分子 | |
| D. | Mg2+中的“2”表示镁元素的化合价为+2价 |
| A. | 单质 | B. | 元素 | C. | 分子 | D. | 化合物 |