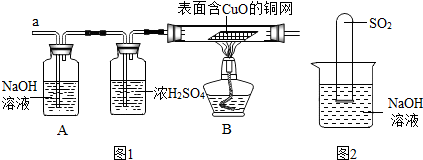
题目内容
下列能达到实验目的方案是( )
A、 探究反应物接触面积对反应速率的影响 探究反应物接触面积对反应速率的影响 |
B、 探究二氧化碳能与水发生反应 探究二氧化碳能与水发生反应 |
C、 探究反应物浓度对反应速率的影响 探究反应物浓度对反应速率的影响 |
D、 探究燃烧的温度是否须达到着火点(白磷着火点:40℃) 探究燃烧的温度是否须达到着火点(白磷着火点:40℃) |
考点:化学实验方案设计与评价,二氧化碳的化学性质,燃烧与燃烧的条件
专题:简单实验方案的设计与评价
分析:A、根据探究反应物接触面积对反应速率的影响只改变反应物的接触面积其他的量不变进行解答;
B、根据验证二氧化碳能与水发生反应还应设计二氧化碳能否使石蕊试液变色以及水能否使石蕊试液变色进行解答;
C、根据探究反应物浓度对反应速率的影响只改变反应物浓度其他的量不变进行解答;
D、根据探究燃烧的温度是否须达到着火点(白磷着火点:40℃)应该是一个大于40℃、一个小于40℃进行解答.
B、根据验证二氧化碳能与水发生反应还应设计二氧化碳能否使石蕊试液变色以及水能否使石蕊试液变色进行解答;
C、根据探究反应物浓度对反应速率的影响只改变反应物浓度其他的量不变进行解答;
D、根据探究燃烧的温度是否须达到着火点(白磷着火点:40℃)应该是一个大于40℃、一个小于40℃进行解答.
解答:解:A、探究反应物接触面积对反应速率的影响只改变反应物的接触面积其他的量不变,此试验中用了块状碳酸钙与粉末状碳酸钙外还用了稀盐酸和稀硫酸,所以不能达到实验目的,故A错误;
B、验证二氧化碳能与水发生反应还应设计二氧化碳能否使石蕊试液变色以及水能否使石蕊试液变色,所以实验②并不能说明是二氧化碳与水反应,有可能是二氧化碳使石蕊试液变的红,故B错误;
C、探究反应物浓度对反应速率的影响只改变反应物浓度其他的量不变,所以二者浓度不同其他的量不变能探究反应物浓度对反应速率的影响,故C正确;
D、探究燃烧的温度是否须达到着火点(白磷着火点:40℃)应该是一个大于40℃、一个小于40℃,而此实验中温度都大于40℃,所以无法探究燃烧的温度是否须达到着火点,故D错误.
故选:C.
B、验证二氧化碳能与水发生反应还应设计二氧化碳能否使石蕊试液变色以及水能否使石蕊试液变色,所以实验②并不能说明是二氧化碳与水反应,有可能是二氧化碳使石蕊试液变的红,故B错误;
C、探究反应物浓度对反应速率的影响只改变反应物浓度其他的量不变,所以二者浓度不同其他的量不变能探究反应物浓度对反应速率的影响,故C正确;
D、探究燃烧的温度是否须达到着火点(白磷着火点:40℃)应该是一个大于40℃、一个小于40℃,而此实验中温度都大于40℃,所以无法探究燃烧的温度是否须达到着火点,故D错误.
故选:C.
点评:解答本题关键是要知道控制变量法中哪些量变哪些量不变,即自变量、因变量,了解对照试验的设计思路,难度较大.

练习册系列答案
相关题目
下列关于催化剂的说法正确的是( )
| A、催化剂只能加快反应速率 |
| B、化学反应中,催化剂参与了反应,性质也发生改变 |
| C、往过氧化氢溶液中加入二氧化锰能使产生氧气的速率加快 |
| D、催化剂在反应后质量会减少 |
 水是生命之源,请回答下列有关水的问题:
水是生命之源,请回答下列有关水的问题: