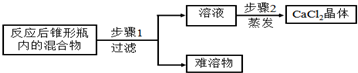
题目内容
4.一包白色粉末可能含NaCl、Na2SO4、Na2CO3、FeCl3、MgCl2中一种或几种,为鉴定其组成,现按照如图做实验:根据图回答:
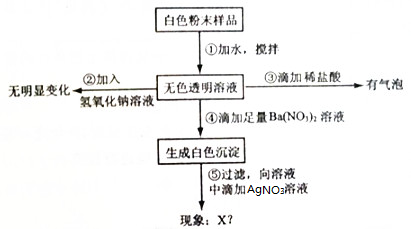
(1)原白色粉末一定含Na2SO4、Na2CO3,一定不含FeCl3、MgCl2;
(2)现象X为产生白色沉淀,写出产生此现象的化学反应方程式AgNO3+NaCl═AgCl↓+NaNO3;
(3)取加水溶解后的无色透明溶液,滴加石蕊试液,溶液显红色.
分析 根据实验现象结合物质的性质及物质间的反应进行分析,①取样加水溶解,得到无色透明溶液,氯化铁的水溶液为黄色,说明一定无氯化铁,氯化镁能与碳酸钠反应生成白色沉淀,说明碳酸钠和氯化镁不能同时存在;②向无色透明溶液加入NaOH溶液,观察,没有明显现象,说明无氯化镁,③向无色透明溶液,滴加稀盐酸,观察,也没有明显现象,说明无碳酸钠;④为证明氯化钠和硫酸钠的存在情况,即验证氯离子或硫酸根离子的存在,为排除硫酸根离子对氯离子检验的干扰,应该先鉴别硫酸根离子,因此滴加A溶液产生沉淀,A溶液是硝酸钡,产生白色沉淀,说明含有硫酸钠;⑤继续向滤液中滴加硝酸银溶液,即验证氯离子的存在,如果产生白色沉淀现象,说明有氯化钠,反之,则无.
解答 解:①取样加水溶解,得到无色透明溶液,氯化铁的水溶液为黄色,说明一定无氯化铁,氯化镁能与碳酸钠反应生成白色沉淀,说明碳酸钠和氯化镁不能同时存在;②向无色透明溶液加入NaOH溶液,观察,没有明显现象,说明无氯化镁,③向无色透明溶液,滴加稀盐酸,观察,也没有明显现象,说明无碳酸钠;④为证明氯化钠和硫酸钠的存在情况,即验证氯离子或硫酸根离子的存在,为排除硫酸根离子对氯离子检验的干扰,应该先鉴别硫酸根离子,因此滴加A溶液产生沉淀,A溶液是硝酸钡,产生白色沉淀,说明含有硫酸钠;⑤继续向滤液中滴加硝酸银溶液,即验证氯离子的存在,如果产生白色沉淀现象,说明有氯化钠,反之,则无.
(1)根据分析,原白色粉末一定含Na2SO4、Na2CO3,一定不含FeCl3、MgCl2;
(2)因为原白色粉末碳酸钠与稀盐酸反应生成氯化钠,而氯化钠与硝酸银溶液反应生成氯化银沉淀和硝酸钠,故现象X为产生白色沉淀,产生此现象的化学反应方程式AgNO3+NaCl═AgCl↓+NaNO3;
(3)根据分析,原白色粉末一定含碳酸钠,故取加水溶解后的无色透明溶液为碱性,故滴加石蕊试液,溶液显红色.
故答案为:
(1)Na2SO4、Na2CO3,FeCl3、MgCl2;
(2)产生白色沉淀,AgNO3+NaCl═AgCl↓+NaNO3;
(3)红.
点评 本题属于框图式的推断题,依据图示的操作及物质的性质、物质间的反应逐渐得出结论;在验证硫酸根离子和氯离子的时候,要注意操作的顺序及加入的试剂不能互相产生干扰.

| A. | 为了保护水资源,应禁止使用农药、化肥 | |
| B. | 通过电解水的实验证明,水是由氢元素和氧元素组成的 | |
| C. | 保持水的化学性质的最小粒子是氢原子和氧原子 | |
| D. | 水在常温下不能与二氧化碳发生反应 |
| 实物图片 |  |  |  |  |
| 名称 | 奖牌 | 吉祥物 | 火炬 | 主会场 |
| 材料 | 黄金、白银、紫铜 | PU皮、化纤填充物 | 丙烷燃料 | 钢筋混凝土 |
(2)关于金银铜化学性质说法正确的是BC(填字母序号)
A.均可以被空气中氧气氧化 B.化学性质依次逐渐活泼
C.均可以导电 D.均可以和稀硫酸反应
(3)写出一个表现银铁两金属活泼性差异反应方程式Fe+2AgNO3=Fe(NO3)2+2Ag.
| A. |  羊毛衫 | B. |  塑料盆 | C. |  不锈钢餐具 | D. |  玻璃杯 |
| A. | +2 | B. | +3 | C. | +4 | D. | +5 |
| A. | 一氧化碳和二氧化碳均具有可燃性 | |
| B. | 一氧化碳和二氧化碳均能与水反应 | |
| C. | 一氧化碳和二氧化碳的密度均大于空气的密度 | |
| D. | 一氧化碳和二氧化碳在一定条件下可以相互转化 |
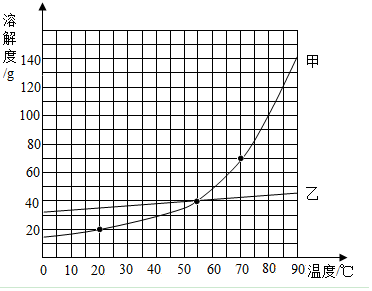 如图是甲乙两种固体物质(不含结晶水)的溶解度曲线,根据图象回答下列问题.
如图是甲乙两种固体物质(不含结晶水)的溶解度曲线,根据图象回答下列问题. ”和“
”和“ ”分别表示氮原子和氧原子,下图是此反应的微观模拟图:
”分别表示氮原子和氧原子,下图是此反应的微观模拟图: