题目内容
4.现有H2SO4和MgSO4的混合溶液,为了分析混合溶液中H2SO4和MgSO4的质量分数,设计图甲实验方案,并得到图乙有关数据.请回答下列问题:
(1)图乙的图象中,ab段表示的是混合溶液中的H2SO4(写化学式)与NaOH发生反应.
(2)与硫酸镁溶液反应的氢氧化钠溶液的质量为40g;请计算该混合溶液中MgSO4的溶质质量分数(写出计算过程).
(3)在c点,混合溶液与NaOH恰好反应完全,此点溶液中的溶质是Na2SO4(写化学式).
(4)在向100g混合溶液中不断加入上述氢氧化钠溶液的过程中,请画出加入氢氧化钠溶液的质量与产生沉淀质量的关系图.(在图丙的坐标图中作图)
分析 (1)根据加入氢氧化钠后没有立即出现沉淀,说明加入的NaOH溶液先跟其中的硫酸反应,后跟硫酸镁反应进行分析;
(2)根据图乙中pH的变化分析与硫酸镁反应的氢氧化钠的质量;再根据氢氧化钠与硫酸镁反应的方程式计算硫酸镁的质量、生成的沉淀的质量等,即可进行有关的计算.
(3)据图乙中pH的变化分析在c点混合溶液与NaOH恰好反应完全,据此判断溶液中的溶质;
(4)根据上述数据做出加入氢氧化钠溶液的质量与产生沉淀质量的关系图;
解答 解:(1)向H2SO4和MgSO4的混合溶液中加入NaOH溶液,氢氧化钠首先与硫酸反应,溶液的pH逐渐变大,当pH等于7时硫酸恰好完全反应,所以,图乙的图象中,ab段表示的是混合溶液中的H2SO4与NaOH发生反应;
(2)由图乙中pH的变化可知,与硫酸镁反应的氢氧化钠的质量为:90g-50g=40g
设:100g混合液中硫酸镁的质量为x,生成沉淀的质量为y
MgSO4+2NaOH=Mg(OH)2↓+Na2SO4
120 80 58
x 40g×20% y
$\frac{120}{x}=\frac{80}{40g×20%}=\frac{58}{y}$ 解得:x=12g y=5.8g
该混合溶液中MgSO4的溶质质量分数是:$\frac{12g}{100g}×100%$=12%
(3)在c点,混合溶液与NaOH恰好反应完全,此点溶液中的溶质是Na2SO4;
(4)由上述分析可知,当加入氢氧化钠溶液50g起开始产生沉淀,当加入到90g时硫酸镁完全反应产生了沉淀是5.8g,所以,加入氢氧化钠溶液的质量与产生沉淀质量的关系图如下: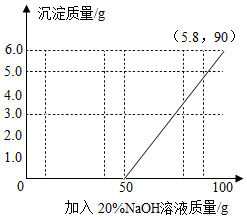
故答为:(1)H2SO4;(2)40,12%;(3)Na2SO4;(4)见上图.
点评 本题主要考查了化学方程式的计算,难度不大,注意解题的规范性和准确性.

| A. | C CaO NaHSO4 | B. | H2 H2O NaOH | C. | O2 NaOH H2SO4 | D. | Fe CO2 H3PO4 |
| A. | 0 | B. | +2 | C. | +3 | D. | +4 |
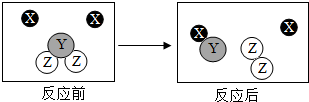 如图是某化学变化的微观示意图,X、Y、Z分别表示不同类别的原子,下列叙述错误的是( )
如图是某化学变化的微观示意图,X、Y、Z分别表示不同类别的原子,下列叙述错误的是( )| A. | 该化学反应中生成物的分子个数比为1:1 | |
| B. | 从微观角度分析,化学反应前后各物质质量总和相等的原因是,化学反应前后原子和种类、数目和质量都没有改变 | |
| C. | 该化学反应的基本类型为置换反应 | |
| D. | 由X原子构成的物质是该反应的催化剂 |


 结合表中(元素周期表的部分)中原子结构示意图,回答有关问题.
结合表中(元素周期表的部分)中原子结构示意图,回答有关问题.