网址:http://m.1010jiajiao.com/timu_id_99541[举报]
(1)某小组同学欲用4mol/L的盐酸配制230mL 0.4mol/L 盐酸溶液,需取用4mol/L盐酸
(2)下列实验操作使配制的溶液浓度偏低的是
A.容量瓶洗涤后未干燥
B.移液时,有少量溶液溅出
C.定容时,加水不慎超过刻度线,又倒出一些
D.定容时,俯视刻度线
E.装入试剂瓶时,有少量溶液溅出
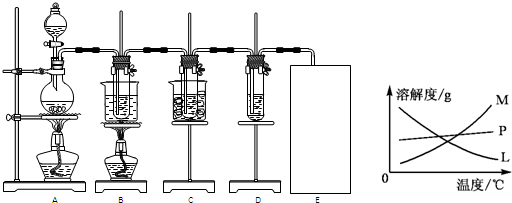
(Ⅱ)瑞典化学家舍勒将软锰矿(主要成分为MnO2)与浓盐酸混合加热,在世界上首先得到了氯气.已知Cl2和碱溶液在不同条件下,得到的产物不同,某兴趣小组用下图所示装置制取氯酸钾、次氯酸钠和探究氯水的性质.( 3Cl2+6KOH
| ||
请填写下列空白:
(1)制取氯气时,在圆底烧瓶里加入一定质量的二氧化锰,通过
| ||
| ||
(2)反应完毕经冷却后,B的试管中有大量晶体析出.图中符合该晶体溶解度曲线的是
(3)实验中可观察到D的试管里溶液的颜色发生了如下变化,请填写下表中的空白:
| 实验现象 | 原因 |
| 溶液最初从紫色逐渐变为 红 红 色 |
氯气与水反应生成的H+使石蕊变色 |
| 随后溶液逐渐变为无色 | 氯气与水反应生成的HClO将石蕊氧化为无色物质 氯气与水反应生成的HClO将石蕊氧化为无色物质 |
KMnO4溶液常用做氧化还原反应滴定的标准液,由于KMnO4的强氧化性,它的溶液很容易被空气中或水中某些少 量还原性物质还原,生成难溶性物质MnO(OH)2,因此配制KMnO4标准溶液的操作是:
量还原性物质还原,生成难溶性物质MnO(OH)2,因此配制KMnO4标准溶液的操作是:
I.称取稍多于所需量的KMnO4固体溶于水,将溶液加热并保持微沸1 h;
II. 用微孔玻璃漏斗(无需滤纸)过滤除去难溶的MnO(OH)2;
III. 过滤得到的KMnO4溶液贮存于棕色试剂瓶放在暗处;
IV. 利用氧化还原滴定方法,在700C-800C条件下用基准试剂(纯度高、相对分子质量较大、稳定性较好的物质,如草酸晶体H2C2O4?2H2O )溶液标定其浓度。已知: MnO4-(H+)→Mn2+、 H2C2O4→ CO2反应中其他元素没有得、失电子。请回答下列问题:
(1)写出在硫酸酸化的条件下KMnO4与H2C2O4反应的离子方程式是 ;
(2)如何保证在700C-800C条件下进行滴定操作: ;
(3)准确量取一定体积(25.00 mL)的KMnO4溶液使用的仪器是 ;
(4)若准确称取W g基准试剂溶于水配成500 mL水溶液,取25.00 mL置于锥形瓶中,用高锰酸钾溶液滴定至终点,消耗高锰酸钾 溶液V mL。问:
溶液V mL。问:
①滴定终点标志是 ;
②KMnO4溶液的物质的量浓度为 mol·L-1;
(5)若用放置两周的KMnO4标准溶液去滴定水样中Fe2+含量,测得的浓度值将 -------(填“偏高”或“偏低”)
KMnO4溶液常用做氧化还原反应滴定的标准液,由于KMnO4的强氧化性,它的溶液很容易被空气中或水中某些少量还原性物质还原,生成难溶性物质MnO(OH)2,因此配制KMnO4标准溶液的操作是:
![]() I. 称取稍多于所需量的KMnO4固体溶于水,将溶液加热并保持微沸1 h;
I. 称取稍多于所需量的KMnO4固体溶于水,将溶液加热并保持微沸1 h;
![]() II. 用微孔玻璃漏斗(无需滤纸)过滤除去难溶的MnO(OH)2;
II. 用微孔玻璃漏斗(无需滤纸)过滤除去难溶的MnO(OH)2;
![]() III. 过滤得到的KMnO4溶液贮存于棕色试剂瓶放在暗处;
III. 过滤得到的KMnO4溶液贮存于棕色试剂瓶放在暗处;
![]() IV. 利用氧化还原滴定方法,在700C-800C条件下用基准试剂(纯度高、相对分子质量较大、稳定性较好的物质,如草酸晶体H2C2O4•2H2O )溶液标定其浓度。已知: MnO4- (H+)→Mn2+ 、 H2C2O4 → CO2 反应中其他元素没有得、失电子。请回答下列问题:
IV. 利用氧化还原滴定方法,在700C-800C条件下用基准试剂(纯度高、相对分子质量较大、稳定性较好的物质,如草酸晶体H2C2O4•2H2O )溶液标定其浓度。已知: MnO4- (H+)→Mn2+ 、 H2C2O4 → CO2 反应中其他元素没有得、失电子。请回答下列问题:
![]() (1)写出在硫酸酸化的条件下KMnO4 与H2C2O4反应的离子方程式是 ;
(1)写出在硫酸酸化的条件下KMnO4 与H2C2O4反应的离子方程式是 ;
![]() (2)如何保证在700C-800C条件下进行滴定操作: ;
(2)如何保证在700C-800C条件下进行滴定操作: ;
![]() (3)准确量取一定体积(25.00 mL)的KMnO4溶液使用的仪器是 ;
(3)准确量取一定体积(25.00 mL)的KMnO4溶液使用的仪器是 ;
![]() (4)若准确称取W g基准试剂溶于水配成500 mL水溶液,取25.00 mL置于锥形瓶中,用高锰酸钾溶液滴定至终点,消耗高锰酸钾溶液V mL。问:
(4)若准确称取W g基准试剂溶于水配成500 mL水溶液,取25.00 mL置于锥形瓶中,用高锰酸钾溶液滴定至终点,消耗高锰酸钾溶液V mL。问:
![]() ①滴定终点标志是 ;
①滴定终点标志是 ;
![]() ②KMnO4溶液的物质的量浓度为 mol?L-1;
②KMnO4溶液的物质的量浓度为 mol?L-1;
![]() (5)若用放置两周的KMnO4标准溶液去滴定水样中Fe2+含量,测得的浓度值将 -------(填“偏高”或“偏低”)
(5)若用放置两周的KMnO4标准溶液去滴定水样中Fe2+含量,测得的浓度值将 -------(填“偏高”或“偏低”)
KMnO4溶液常用做氧化还原反应滴定的标准液,由于KMnO4的强氧化性,它的溶液很容易被空气中或水中某些少![]() 量还原性物质还原,生成难溶性物质MnO(OH)2,因此配制KMnO4标准溶液的操作是:
量还原性物质还原,生成难溶性物质MnO(OH)2,因此配制KMnO4标准溶液的操作是:
I. 称取稍多于所需量的KMnO4固体溶于水,将溶液加热并保持微沸1 h;
II. 用微孔玻璃漏斗(无需滤纸)过滤除去难溶的MnO(OH)2;
III. 过滤得到的KMnO4溶液贮存于棕色试剂瓶放在暗处;
IV. 利用氧化还原滴定方法,在700C-800C条件下用基准试剂(纯度高、相对分子质量较大、稳定性较好的物质,如草酸晶体H2C2O4??2H2O )溶液标定其浓度。已知: MnO4- (H+)→Mn2+ 、 H2C2O4 → CO2 反应中其他元素没有得、失电子。请回答下列问题:
(1)写出在硫酸酸化的条件下KMnO4 与H2C2O4反应的离子方程式是 ;
(2)如何保证在700C-800C条件下进行滴定操作: ;
(3)准确量取一定体积(25.00 mL)的KMnO4溶液使用的仪器是 ;
(4)若准确称取W g基准试剂溶于水配成500 mL水溶液,取25.00 mL置于锥形瓶中,用高锰酸钾溶液滴定至终点,消耗高锰酸钾![]() 溶液V mL。问:
溶液V mL。问:
①滴定终点标志是 ;
②KMnO4溶液的物质的量浓度为 mol·L-1;
(5)若用放置两周的KMnO4标准溶液去滴定水样中Fe2+含量,测得的浓度值将 -------(填“偏高”或“偏低”)
查看习题详情和答案>> 量还原性物质还原,生成难溶性物质MnO(OH)2,因此配制KMnO4标准溶液的操作是:
量还原性物质还原,生成难溶性物质MnO(OH)2,因此配制KMnO4标准溶液的操作是:I.称取稍多于所需量的KMnO4固体溶于水,将溶液加热并保持微沸1 h;
II. 用微孔玻璃漏斗(无需滤纸)过滤除去难溶的MnO(OH)2;
III. 过滤得到的KMnO4溶液贮存于棕色试剂瓶放在暗处;
IV. 利用氧化还原滴定方法,在700C-800C条件下用基准试剂(纯度高、相对分子质量较大、稳定性较好的物质,如草酸晶体H2C2O4?2H2O )溶液标定其浓度。已知: MnO4-(H+)→Mn2+、 H2C2O4→ CO2反应中其他元素没有得、失电子。请回答下列问题:
(1)写出在硫酸酸化的条件下KMnO4与H2C2O4反应的离子方程式是 ;
(2)如何保证在700C-800C条件下进行滴定操作: ;
(3)准确量取一定体积(25.00 mL)的KMnO4溶液使用的仪器是 ;
(4)若准确称取W g基准试剂溶于水配成500 mL水溶液,取25.00 mL置于锥形瓶中,用高锰酸钾溶液滴定至终点,消耗高锰酸钾
 溶液V mL。问:
溶液V mL。问:①滴定终点标志是 ;
②KMnO4溶液的物质的量浓度为 mol·L-1;
(5)若用放置两周的KMnO4标准溶液去滴定水样中Fe2+含量,测得的浓度值将 -------(填“偏高”或“偏低”)