网址:http://m.1010jiajiao.com/timu_id_92655[举报]
一、 选择题(本大题共10题,每小题2分,共20分)每小题给出的四个选项中,只有一个最符合题意,请将其序号涂在答题卡上。
题号
1
2
3
4
5
6
7
8
9
10
答案
B
C
D
B
D
B
B
A
D
C
二、选择题(本大题共5题,每小题2分,共10分)每小题给出的四个选项中,有1~2个符合题意。只有一个选项符合题意的多选不给分;有2个选项符合题意的只选一个且符合题意给1分,若选2个有一个不符合题意则不给分。
题号
11
12
13
14
15
答案
BD
BC
AC
C
D
三、(本大题共5题 共23分)
16.(6分)(每空1分) (1)CO (2)干冰(3)排水法(4)石墨具有导电性(5)80(6)+5
17.(4分)(每空1分) (1)天然 合成 (2)铁 (3)③
18.(5分)(每空1分) (1)40(2)乙 甲 丙 (3)升高温度或加入丙物质或恒温蒸发水
(4)甲 丙
19.(5分)(每空1分) (1)CO2 (2)CO2 CH3COOH (3)石蕊试液 (4)2
20.(2分) 15:2
四、(本大题共4题 共37分)
(1)4P+5O2======2P2O5
(3)CO+CuO====Cu+CO2
(4)CuSO4+2NaOH ====Cu(OH)2↓+Na2SO4 (2)
22.(11分) (每空1分,化学方程式2分,最后一空2分)(1) CO2 Cu (2) Cu、Na2CO3、Cu(OH)2、CuO;Cu、Na2CO3、CuO;Cu、Na2CO3、Cu(OH)2;(3)CuSO4、H2SO4(4)CuO+H2SO4==CuSO4+H2O或Cu(OH)2+H2SO4==CuSO4+2H2O(5)NaOH,取溶液B少许滴加过量的BaCl2溶液静置(或过滤),取上层清液滴入酚酞,若变红色则含有NaOH,反之则无NaOH。
 23.(9分) (每空1分,化学方程式2分)(1)H2 Zn+H2SO4====ZnSO4+H2↑(2)①②③④⑥ (3)黑色粉末变红,试管内壁出现水珠 (4)酒精灯
23.(9分) (每空1分,化学方程式2分)(1)H2 Zn+H2SO4====ZnSO4+H2↑(2)①②③④⑥ (3)黑色粉末变红,试管内壁出现水珠 (4)酒精灯
2KMnO4=====K2MnO4+MnO2+O2↑ 将带火星的木条插入集气瓶中,若木条复燃,证明是氧气。
24.(9分)(每空1分) 实验一 B烧杯中的无色酚酞溶液变红
实验二 验证水和二氧化碳分别是否能使紫色石蕊变色 B
实验三
1
加入等体积的蒸馏水和氢氧化钠溶液,盖紧瓶塞,振荡。
加入氢氧化钠溶液的软塑料瓶比加入蒸馏水的软塑料瓶变得更瘪
2
加入足量的盐酸(或氯化钡溶液或澄清石灰水或氯化钙溶液或硝酸钡溶液……
冒气泡(或有白色沉淀生成……)
(说明:所写步骤、现象要匹配,其他合理答案均可给分)
方案1:通过密闭容器内气体压强变化的程度的对比来判断反应的发生(或通过反应物量的减少来判断反应的发生。)
方案2:通过验证生成物的存在来判断反应的发生。
五、(本大题共2题 共10分)
25.(3分)(每空1分)(1) (2)1290
(2)1290
(3)解法一: 解法二:
解法二:
26.(7分)(1) 碱 ;酸 (每空1分) (2)溶液的红色刚好褪去(1分)
(3)消耗掉的硫酸溶液质量:24.5mL×
消耗掉的硫酸溶液中溶质的质量:
解: 设待测液溶质质量为x
2NaOH + H2SO4 ===== Na2SO4+2 H2O
80 98
x
80 :98 = x :
x=
待测液溶质质量分数为
答: 待测液溶质质量分数为3.6%
本资料由《七彩教育网》www.7caiedu.cn 提供!
硫酸是常见的酸,也是常用的化工原料。由于浓度不同,浓硫酸与稀硫酸在性质上存在较大差异,如浓硫酸具有脱水性、吸水性和强腐蚀性等。某课外兴趣小组为了探究浓硫酸的某些特性做了如下一些实验。请结合有关实验,按要求回答下列问题:
⑴用玻璃棒蘸取少量浓硫酸在滤纸上写字,过后观察,字迹显黑色,这主要是由于浓硫酸具
有 性,使纸中的纤维素炭化的缘故;在洗气瓶中盛放浓硫酸,除去氢气或氧气中的水分,是利用其 性。
⑵探究浓硫酸的吸水性。兴趣小组把98%的硫酸10mL和63.3%的硫酸(用10mL98%的硫酸与10mL水配成)约20mL分别放入两个相同的大表面皿中,称量、观察、记录、分析。根据室温环境下实验的数据绘成的曲线如右图:
①稀释浓硫酸时,应将 缓缓地注入盛有 的烧杯中并不断搅拌;
②由右图曲线你能得到的实验结论有哪些? (写两点) 、 。
⑶探究浓硫酸能否使铁钝化(钝化指在表面形成 氧化膜保护层,使内层金属不再发生变化)。
可选用的实验药品有:相同铁片若干、浓硫酸、稀硫酸、硫酸铜溶液等。实验仪器任选。
①兴趣小组已经完成下表实验Ⅰ和Ⅱ,请你帮他们将实验报告补充完整。
| 方案 | 实验假设 | 实验方案 | 实验现象与结论 |
| Ⅰ | 能发生钝化 | 取一铁片先插入浓硫酸中,一段时间后取出,再插入硫酸铜溶液中。 | 无明显变化,假设成立。 |
| Ⅱ | 能发生钝化 | 取两片相同的铁片,一片放入浓硫酸中,一段时间后取出,与另一片同时放入硫酸铜溶液中。 | ,假设成立。 |
你认为方案Ⅱ与方案Ⅰ相比,方案Ⅱ的优点是 。
②请你选用提供的药品再设计一个实验,简述实验方案: 。
③某同学将一铁片插入盛有98%的浓硫酸的试管中,无明显变化,再给试管加热一段时间后,发现溶液变色并有刺激性气味气体产生,此现象说明: 。

硫酸是常见的酸,也是常用的化工原料。由于浓度不同,浓硫酸与稀硫酸在性质上存在较大差异,如浓硫酸具有脱水性、吸水性和强腐蚀性等。某课外兴趣小组为了探究浓硫酸的某些特性做了如下一些实验。请结合有关实验,按要求回答下列问题:
⑴用玻璃棒蘸取少量浓硫酸在滤纸上写字,过后观察,字迹显黑色,这主要是由于浓硫酸具有 性,使纸中的纤维素炭化的缘故;在洗气瓶中盛放浓硫酸,除去氢气或氧气中的水分,是利用其 性。
⑵探究浓硫酸的吸水性。兴趣小组把98%的硫酸10mL和63.3%的硫酸(用10mL98%的硫酸与10mL水配成)约20mL分别放入两个相同的大表面皿中,称量、观察、记录、分析。根据室温环境下实验的数据绘成的曲线如右图:
①稀释浓硫酸时,应将 缓缓地注入盛有 的烧杯中并不断搅拌;
②由右图曲线你能得到的实验结论有哪些?  (写两点) 、 。
(写两点) 、 。
⑶探究浓硫酸能否使铁钝化(钝化指在表面形成
氧化膜保护层,使内层金属不再发生变化)。
可选用的实验药品有:相同铁片若干、浓硫酸、
稀硫酸、硫酸铜溶液等。实验仪器任选。
①兴趣小组已经完成下表实验Ⅰ和Ⅱ,请你帮他们将实验报告补充完整。
| 方案 | 实验假设 | 实验方案 | 实验现象与结论 |
| Ⅰ | 能发生钝化 | 取一铁片先插入浓硫酸中,一段时间后取出,再插入硫酸铜溶液中。 | 无明显变化,假设成立。 |
| Ⅱ | 能发生钝化 | 取两片相同的铁片,一片放入浓硫酸中,一段时间后取出,与另一片同时放入硫酸铜溶液中。 | ,假设成立。 |
你认为方案Ⅱ与方案Ⅰ相比,方案Ⅱ的优点是 。
②请你选用提供的药品再设计一个实验,简述实验方案: 。
③某同学将一铁片插入盛有98%的浓硫酸的试管中,无明显变化,再给试管加热一段时间后,发现溶液变色并有刺激性气味气体产生,此现象说明: 。
查看习题详情和答案>>铜屑与稀硫酸不发生反应,若在稀硫酸中加入过氧化氢(H2O2),铜屑可逐渐溶解。
(1)铜屑溶解是因为发生了如下反应,请完成该反应的化学方程式。Cu+H2SO4+H2O2===CuSO4+
(2)若选用的稀硫酸溶质的质量分数为9.8%,则用100 mL98%的浓硫酸(密度为1.8g/cm3)配制该稀硫酸,需加水_________g.
(3)取一定量上述稀释后的硫酸(其中含溶质98g),然后加入34%的过氧化氢溶液,铜屑恰好完全反应,假定硫酸不和其他杂质反应,则反应后硫酸铜溶液的质量为____________.
查看习题详情和答案>>
使用浓硫酸时要十分小心,浓硫酸有强烈的 !所以,不要将浓硫酸沾到皮肤或衣服上。为了加深记忆,小丽同学用下图形象地总结了硫酸能与5类物质发生反应。请你根据要求完成下列问题。
(1)将紫色石蕊溶液滴入稀硫酸溶液中,紫色石蕊溶液遇稀硫酸变成 ;
(2)稀硫酸能够除铁锈(铁锈的主要成分Fe2O3),除锈后溶液颜色的变化情况是 ,
写出反应的化学方程式 ;
(3)为了验证反应⑤能够发生,应选择的物质是 ;
| A.NaCl溶液 | B.NaOH溶液 |
| C.Ba(NO3 )2溶液 | D.MgCl2溶液 |


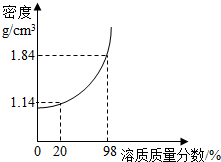 右图为硫酸溶液溶质质量分数与密度关系图.
右图为硫酸溶液溶质质量分数与密度关系图.