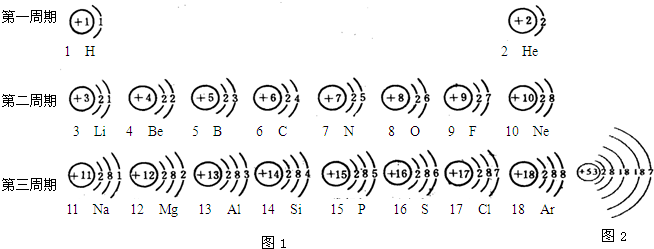
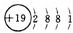摘要:(1)第11号元素名称是 .它属于 元素.它在化学反应中容易 电子.它的离子符号为 .(2)从上表中我还可以探究出以下规律:原子核外电子数等于原子序数. 等于 .
网址:http://m.1010jiajiao.com/timu_id_922008[举报]
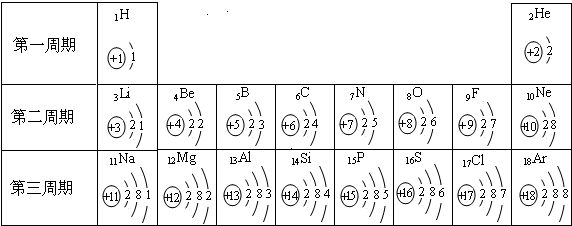
元素周期表是我们学习和研究化学的重要工具.如图是元素周期表中1---18号元素原子的核外电子排布,我们对它进行研究:
(1)第17号元素的名称是
(2)从上表中我们还可以探究出以下规律:
①原子序数与原子核电荷数在数值上相等;
②
③
④
查看习题详情和答案>>
| 第一周期 | 1 H |
2 He | ||||||
| 第二周期 | 3 Li |
4 Be |
5 B |
6 C |
7 N |
8 O |
9 F |
10 Ne |
| 第三周期 | 11 Na |
12 Mg |
13 Al |
14 Si |
15 P |
16 S |
17 Cl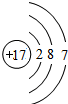 |
18 Ar |
氯
氯
,它属于非金属
非金属
元素(填“金属”或“非金属”),它在化学反应中容易得
得
(填“得”或“失”)电子.(2)从上表中我们还可以探究出以下规律:
①原子序数与原子核电荷数在数值上相等;
②
同周期元素原子的电子层数相同
同周期元素原子的电子层数相同
;③
同一族元素原子最外层电子数相同
同一族元素原子最外层电子数相同
;④
随着核电荷数的递增,元素原子最外层电子的排布呈现周期性的变化
随着核电荷数的递增,元素原子最外层电子的排布呈现周期性的变化
.元素周期表是学习化学的重要工具.如图是元素周期表中1~18号元素原子核外电子排布,我们对它进行研究:

(1)生物体中含量最多的元素名称是
(2)某原子结构示意图为 ,其中X值为
,其中X值为
(3)原子序数为12和17的原子不属于同一种元素,原因是
A.质子数 B.相对原子质量 C.中子数 D.电子数
(4)研究表明:第二周期3~9号元素的原子电子层数相同,核电荷数逐渐增大,核对核外电子的引力逐渐增大,故原子半径逐渐减小.我分析第三周期11~17号元素原子半径变化规律是
查看习题详情和答案>>

(1)生物体中含量最多的元素名称是
氧
氧
,该元素属于非金属
非金属
元素(填“金属”或“非金属”),它在化学反应中容易得
得
(填“得”或“失”)电子.(2)某原子结构示意图为
 ,其中X值为
,其中X值为20
20
,它位于元素周期表里第四
四
周期,该粒子的最外层电子数为2
2
.(3)原子序数为12和17的原子不属于同一种元素,原因是
A
A
不同(填字母).A.质子数 B.相对原子质量 C.中子数 D.电子数
(4)研究表明:第二周期3~9号元素的原子电子层数相同,核电荷数逐渐增大,核对核外电子的引力逐渐增大,故原子半径逐渐减小.我分析第三周期11~17号元素原子半径变化规律是
原子半径逐渐减小
原子半径逐渐减小
.元素周期表是我们学习化学和研究化学的重要工具.下表是元素周期表中1~18号元素原子的核外电子排布,请回答:
(1)第13号元素名称是
(2)原子序数为11、17的元素组成化合物的化学式
(3)对1~18号元素的原子结构示意图进行分析,可以发现许多规律,如第一周期元素的原子核外只有一个电子层.请再总结出其他规律,并写出其中两条:
①

查看习题详情和答案>>
(1)第13号元素名称是
铝
铝
,它属于金属
金属
(填“金属”或“非金属”)元素,它在化学反应中容易失去
失去
电子,它的离子符号为Al3+
Al3+
.(2)原子序数为11、17的元素组成化合物的化学式
NaCl
NaCl
.(3)对1~18号元素的原子结构示意图进行分析,可以发现许多规律,如第一周期元素的原子核外只有一个电子层.请再总结出其他规律,并写出其中两条:
①
每一周期元素的原子的核外电子层数相同
每一周期元素的原子的核外电子层数相同
;②每一周期元素原子的最外层电子数从左到右逐渐增加
每一周期元素原子的最外层电子数从左到右逐渐增加
.