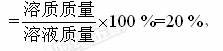摘要:[定量分析]他们取了1000g溶质质量分数为3.4%的硝酸银溶液.加入过量的上述活泼金属充分反应后过滤.洗涤.干燥.称重得金属混合物24.0g.则他们所加的活泼金属的质量是多少?
网址:http://m.1010jiajiao.com/timu_id_921102[举报]
【解析】选A。根据溶质质量分数的定义,溶质质量分数是溶质质量与溶液质量的比值。10%的氯化钠溶液的意义可理解为:将10 g氯化钠溶解在90 g水中所得的溶液,即100 g氯化钠溶液中含有10 g氯化钠。由此可知氯化钠、水、溶液质量之比为1∶9∶10 。其中100 g应指的是溶液质量,10 g指的是溶质质量。故A错。
查看习题详情和答案>>2011年11月25日,在湖南永州发生一起运载浓盐酸(HCl的质量分数为36.5%)的大卡车侧翻事故,导致10t浓盐酸倾泻,事后有关部门迅速到现场处理。
请计算:
(1)该10t浓盐酸中的HCl的质量为 t。
(2)如果用氢氧化钙中和这些盐酸,最少需要多少质量的氢氧化钙?
【解析】(1)根据溶质质量分数的公式求出10t浓盐酸中的HCl的质量;
(2)根据氢氧化钙与盐酸反应的方程式,由HCl的质量求出的氢氧化钙的质量.
查看习题详情和答案>>
(1)某校研究性学习小组欲配制1000g溶质质量分数为15%的氢氧化钠溶液.需氢氧化钠固体 g,水 mL(水的密度是1g/cm3);称量氢氧化钠时 (填“能”或“不能”)放在纸上称量.
(2)甲乙丙丁四位同学在探究碱溶液与酚酞作用的实验时,发现了一个意外现象:氢氧化钠溶液滴入酚酞试液,溶液变成了红色,一会儿红色就消失了.
【猜想】:
甲:可能是酚酞变质的缘故;
乙:可能是氢氧化钠溶液与空气中二氧化碳反应的缘故;
丙:可能是酚酞与空气中氧气反应,使红色消失的缘故;
丁:可能与氢氧化钠溶液质量分数大小有关.
【理论分析】:
①甲同学刚提出自己的猜想,就遭到其余三位同学的否定,三位同学的理由是 .
②乙同学的猜想也不正确,理由是 .
【实验设计】:
③为证实丙同学的猜想,还需作如下实验,请完成下表.
④通过以上实验,四位同学看到:溶液先变成红色,一会儿红色又消失.因此酚酞红色褪去与氧气无关.若丁同学的猜想正确,设计如下实验证明并完成有关问题:
实验方法:观察到的现象和结论;
(3)质量分数小的溶液中红色不消失,质量分数大的溶液中红色会消失,则证明
.
方案二:将滴有酚酞试液的质量分数大的氢氧化钠溶液加水稀释观察到的现象和结论: .
(4)(8分)该校研究性学习小组向上述所配制的15%的氢氧化钠溶液中滴加稀盐酸,有气泡产生,由此可知所用的NaOH固体已变质.写出氢氧化钠在空气中变质的化学方程式 ;所以氢氧化钠应该 保存.(2分)
【提出问题】:所用的NaOH变质程度怎样?
【设计方案】:先称取21.2g 的NaOH样品(杂质为Na2CO3),配成溶液,然后向溶液中逐滴加入一定质量分数的稀硫酸直至过量,根据生成CO2的质量计算出Na2CO3的质量,从而进一步确定样品中NaOH的质量分数.
【进行实验】:实验测得加入稀硫酸的质量与产生CO2气体的质量关系如下图所示.
【数据处理】:写出以下计算过程:
(5)该样品中NaOH的质量分数为多少?
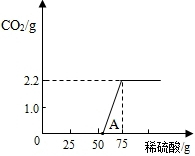
【反思与交流】:①从图中0~A点说明:在NaOH 与Na2CO3的混合溶液中,加入稀硫酸,首先反应的物质是 ;②根据反应方程式分析,NaOH部分变质或全部变质,与没有变质的NaOH相比,中和反应时消耗稀硫酸的量 (填“相等”或“大于”或“小于”.(2分)
查看习题详情和答案>>
(2)甲乙丙丁四位同学在探究碱溶液与酚酞作用的实验时,发现了一个意外现象:氢氧化钠溶液滴入酚酞试液,溶液变成了红色,一会儿红色就消失了.
【猜想】:
甲:可能是酚酞变质的缘故;
乙:可能是氢氧化钠溶液与空气中二氧化碳反应的缘故;
丙:可能是酚酞与空气中氧气反应,使红色消失的缘故;
丁:可能与氢氧化钠溶液质量分数大小有关.
【理论分析】:
①甲同学刚提出自己的猜想,就遭到其余三位同学的否定,三位同学的理由是
②乙同学的猜想也不正确,理由是
【实验设计】:
③为证实丙同学的猜想,还需作如下实验,请完成下表.
| 实验步骤 | 设计这一步骤的目的 |
| 1.用煮沸过的蒸馏水配制氢氧化钠溶液. | |
| 2.在氢氧化钠溶液中滴入酚酞,并在上方滴一些植物油. |
实验方法:观察到的现象和结论;
(3)质量分数小的溶液中红色不消失,质量分数大的溶液中红色会消失,则证明
方案二:将滴有酚酞试液的质量分数大的氢氧化钠溶液加水稀释观察到的现象和结论:
(4)(8分)该校研究性学习小组向上述所配制的15%的氢氧化钠溶液中滴加稀盐酸,有气泡产生,由此可知所用的NaOH固体已变质.写出氢氧化钠在空气中变质的化学方程式
【提出问题】:所用的NaOH变质程度怎样?
【设计方案】:先称取21.2g 的NaOH样品(杂质为Na2CO3),配成溶液,然后向溶液中逐滴加入一定质量分数的稀硫酸直至过量,根据生成CO2的质量计算出Na2CO3的质量,从而进一步确定样品中NaOH的质量分数.
【进行实验】:实验测得加入稀硫酸的质量与产生CO2气体的质量关系如下图所示.
【数据处理】:写出以下计算过程:
(5)该样品中NaOH的质量分数为多少?

【反思与交流】:①从图中0~A点说明:在NaOH 与Na2CO3的混合溶液中,加入稀硫酸,首先反应的物质是
实验室常用的干燥剂“碱石灰”是CaO和NaOH固体的混合物.同学们为确认一瓶久置的“碱石灰”样品的成分,进行如下实验探究.

【查阅资料】①Ca(OH)2、Na2CO3溶于水无明显的温度变化.
②CaCl2溶液呈中性.
(1)为了使少量样品充分溶解,操作①一定还要用到的玻璃仪器是;滤渣B中一定含有
(2)滤液C成分的探究.
【猜想】滤液C中的溶质可能为:
①NaOH; ②Na2CO3; ③NaOH和Ca(OH)2; ④NaOH和Na2CO3.
【设计方案并进行实验】甲、乙、丙同学分别设计如下方案并进行探究:
甲同学:取少量滤液C放入试管中,滴加足量的稀盐酸,产生大量无色气体,则滤液C中的溶质是Na2CO3.
乙同学:取少量滤液C放入试管中,滴加足量的无色酚 酞溶液,溶液变成红色,则滤液C中的溶质一定含有NaOH.
丙同学:取少量滤液C放入试管中,滴加Ca(OH)2溶液,有白色沉淀产生.向上层清液中滴加无色酚酞溶液,溶液变成红色,则滤液C中的溶质是NaOH和Na2CO3.
【反思与评价】丁同学认真分析上述三位同学的实验,认为他们的结论均有不足之处,并且做出了正确的判断.他认为滤液C中的溶质一定含有
(3)实验过程中,同学们还发现向样品中加入足量水溶解时放出大量的热.综合对滤液和滤渣成分的探究,下列对样品成分的分析正确的是
①样品中一定含NaOH
②样品中一定含Na2CO3
③样品中含NaOH、CaO中的一种或两种.
查看习题详情和答案>>

【查阅资料】①Ca(OH)2、Na2CO3溶于水无明显的温度变化.
②CaCl2溶液呈中性.
(1)为了使少量样品充分溶解,操作①一定还要用到的玻璃仪器是;滤渣B中一定含有
CaCO3
CaCO3
(填化学式).(2)滤液C成分的探究.
【猜想】滤液C中的溶质可能为:
①NaOH; ②Na2CO3; ③NaOH和Ca(OH)2; ④NaOH和Na2CO3.
【设计方案并进行实验】甲、乙、丙同学分别设计如下方案并进行探究:
甲同学:取少量滤液C放入试管中,滴加足量的稀盐酸,产生大量无色气体,则滤液C中的溶质是Na2CO3.
乙同学:取少量滤液C放入试管中,滴加足量的无色酚 酞溶液,溶液变成红色,则滤液C中的溶质一定含有NaOH.
丙同学:取少量滤液C放入试管中,滴加Ca(OH)2溶液,有白色沉淀产生.向上层清液中滴加无色酚酞溶液,溶液变成红色,则滤液C中的溶质是NaOH和Na2CO3.
【反思与评价】丁同学认真分析上述三位同学的实验,认为他们的结论均有不足之处,并且做出了正确的判断.他认为滤液C中的溶质一定含有
Na2CO3
Na2CO3
(填化学式),可能含有NaOH.为进一步确认滤液C中是否含NaOH,请你帮助他设计实验进行验证.| 实验操作 | 实验现象 | 实验结论 |
| |
|
猜想④正确 |
②③
②③
(填序号).①样品中一定含NaOH
②样品中一定含Na2CO3
③样品中含NaOH、CaO中的一种或两种.