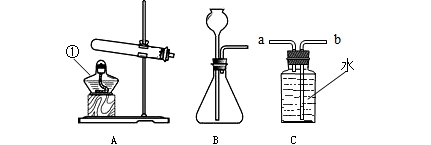
摘要:①可用装置A制取的气体有 ②装置C可用于收集中① 气体.装置D可用于收集中① 气体.装置B可用于收集中① 气体.③若用装置B除去二氧化碳中少量的水蒸气.可在装置中装入 .气体应从 端进入.控制变量是科学探究的重要方法之一.小华同学实验中发现:把质量相等的不同物质放入同样一杯水中.有的溶解快.有的溶解多.有的溶解又快又多.是哪些因素影响着物质溶解的快慢与多少呢?请你参考下表硝酸钾的溶解度随温度的变化关系.以硝酸钾为例.选择一种可能影响硝酸钾溶解快慢的因素设计实验进行探究:温度(℃)20304050607080溶解度(g)
网址:http://m.1010jiajiao.com/timu_id_918721[举报]
气体的实验室制法是一种重要的实验基本技能,请回顾二氧化碳的实验室制法,回答下列问题:
(1)化学反应能生成二氧化碳的反应很多,如见下面反应
①C+O2
CO2
②Na2CO3+2HCl=2NaCl+H20+CO2↑
③CaCO3+2HCl=2CaCl2+H20+CO2↑
④CaC2O4
CaO+CO↑+CO2↑
⑤CO+Fe2O3
2Fe+3CO2
…
请任意分析上面一个不适合于实验制取二氧化碳的反应的原因:
(2)盐酸密度(20℃时)和其溶质质量分数之间的关系
①分析上述数据可得到一个结论:
②现要配制200ml溶质质量分数为8.5%的稀盐酸用于制取二氧化碳,则需要溶质质量分数为37.2%的浓盐酸
(3)下面是二氧化碳的制取、净化、收集和量气的相关实验
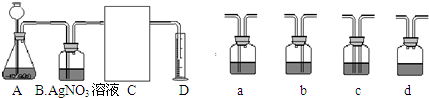
(温馨提示:C装置中装饱和碳酸氢钠溶液,二氧化碳不溶于饱和碳酸氢钠溶液)
①A中的长颈漏斗如果用分液漏斗代替的好处是
②实验过程B装置产生的主要实验现象是:
涉及化学反应是
③方线框中的C装置应该选择上面提供的a、b、c、d的
查看习题详情和答案>>
(1)化学反应能生成二氧化碳的反应很多,如见下面反应
①C+O2
| ||
②Na2CO3+2HCl=2NaCl+H20+CO2↑
③CaCO3+2HCl=2CaCl2+H20+CO2↑
④CaC2O4
| ||
⑤CO+Fe2O3
| ||
…
请任意分析上面一个不适合于实验制取二氧化碳的反应的原因:
反应②Na2CO3+2HCl═2NaCl+H20+CO2↑该反应速率太快,不利于收集
反应②Na2CO3+2HCl═2NaCl+H20+CO2↑该反应速率太快,不利于收集
.现提供有①纯净的CaCO3白色粉末,②大理石,③稀盐酸,③浓盐酸,④稀硫酸,⑤浓硫酸.其中最适合用于实验室制取二氧化碳的药品是②③
②③
(填代号)(2)盐酸密度(20℃时)和其溶质质量分数之间的关系
| 密度(ρ)/g?ml-1 | 1.00 | 1.02 | 1.04 | 1.06 | 1.08 | 1.10 | 1.12 | 1.14 | 1.16 | 1.185 |
| 溶质质量分数(w)/% | 0.4 | 4.4 | 8.5 | 12.5 | 16.5 | 20.4 | 24.2 | 28.2 | 32.2 | 37.2 |
溶液质量分数越大,其密度也越大
溶液质量分数越大,其密度也越大
;盐酸是氯化氢气体溶于水得到的溶液,升高盐酸溶液的温度,其密度将变减小
减小
.②现要配制200ml溶质质量分数为8.5%的稀盐酸用于制取二氧化碳,则需要溶质质量分数为37.2%的浓盐酸
40.1mL
40.1mL
ml.配制过程中要用到量筒、胶头滴管
胶头滴管
、烧杯、玻璃棒等仪器.(3)下面是二氧化碳的制取、净化、收集和量气的相关实验

(温馨提示:C装置中装饱和碳酸氢钠溶液,二氧化碳不溶于饱和碳酸氢钠溶液)
①A中的长颈漏斗如果用分液漏斗代替的好处是
分液漏斗比长颈漏斗能更方便的控制反应速率
分液漏斗比长颈漏斗能更方便的控制反应速率
②实验过程B装置产生的主要实验现象是:
产生白色沉淀
产生白色沉淀
;涉及化学反应是
AgNO3+HC═lAgCl↓+HNO3
AgNO3+HC═lAgCl↓+HNO3
.③方线框中的C装置应该选择上面提供的a、b、c、d的
a
a
.气体制取是重要的化学实验活动,请根据给出的装置回答下列问题: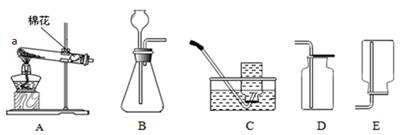
(1)请写出图A中仪器a的名称:① 。
(2)用高锰酸钾制取并收集较纯的氧气,选择的装置是 (填字母序号)。
(3)在实验室中选用B装置制取氧气,反应原理是 (填字 母 序号);用这种方法制得的氧气常含有少量水蒸气,若用下图所示装置除去水蒸气,气体应从 (填“b”或 “c”)端进入。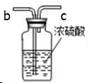
(4)实验室制取二氧化碳时,可将 放到集气瓶口来判断是否已集满二氧化碳气体,实验室不适宜用排水法收集二氧化碳的理由是 。
气体的实验室制法是一种重要的实验基本技能,请回顾二氧化碳的实验室制法,回答下列问题:
(1)化学反应能生成二氧化碳的反应很多,如见下面反应
①C+O2 CO2
CO2
②Na2CO3+2HCl=2NaCl+H20+CO2↑
③CaCO3+2HCl=2CaCl2+H20+CO2↑
④CaC2O4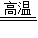 CaO+CO↑+CO2↑
CaO+CO↑+CO2↑
⑤CO+Fe2O3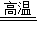 2Fe+3CO2
2Fe+3CO2
…
请任意分析上面一个不适合于实验制取二氧化碳的反应的原因:______.现提供有①纯净的CaCO3白色粉末,②大理石,③稀盐酸,③浓盐酸,④稀硫酸,⑤浓硫酸.其中最适合用于实验室制取二氧化碳的药品是______(填代号)
(2)盐酸密度(20℃时)和其溶质质量分数之间的关系
①分析上述数据可得到一个结论:______;盐酸是氯化氢气体溶于水得到的溶液,升高盐酸溶液的温度,其密度将变______.
②现要配制200ml溶质质量分数为8.5%的稀盐酸用于制取二氧化碳,则需要溶质质量分数为37.2%的浓盐酸______ml.配制过程中要用到量筒、______、烧杯、玻璃棒等仪器.
(3)下面是二氧化碳的制取、净化、收集和量气的相关实验
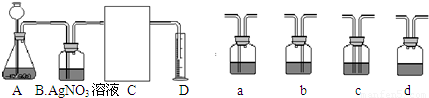
(温馨提示:C装置中装饱和碳酸氢钠溶液,二氧化碳不溶于饱和碳酸氢钠溶液)
①A中的长颈漏斗如果用分液漏斗代替的好处是______
②实验过程B装置产生的主要实验现象是:______;
涉及化学反应是______.
③方线框中的C装置应该选择上面提供的a、b、c、d的______.
查看习题详情和答案>>
(1)化学反应能生成二氧化碳的反应很多,如见下面反应
①C+O2
 CO2
CO2②Na2CO3+2HCl=2NaCl+H20+CO2↑
③CaCO3+2HCl=2CaCl2+H20+CO2↑
④CaC2O4
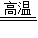 CaO+CO↑+CO2↑
CaO+CO↑+CO2↑⑤CO+Fe2O3
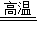 2Fe+3CO2
2Fe+3CO2…
请任意分析上面一个不适合于实验制取二氧化碳的反应的原因:______.现提供有①纯净的CaCO3白色粉末,②大理石,③稀盐酸,③浓盐酸,④稀硫酸,⑤浓硫酸.其中最适合用于实验室制取二氧化碳的药品是______(填代号)
(2)盐酸密度(20℃时)和其溶质质量分数之间的关系
| 密度(ρ)/g?ml-1 | 1.00 | 1.02 | 1.04 | 1.06 | 1.08 | 1.10 | 1.12 | 1.14 | 1.16 | 1.185 |
| 溶质质量分数(w)/% | 0.4 | 4.4 | 8.5 | 12.5 | 16.5 | 20.4 | 24.2 | 28.2 | 32.2 | 37.2 |
②现要配制200ml溶质质量分数为8.5%的稀盐酸用于制取二氧化碳,则需要溶质质量分数为37.2%的浓盐酸______ml.配制过程中要用到量筒、______、烧杯、玻璃棒等仪器.
(3)下面是二氧化碳的制取、净化、收集和量气的相关实验

(温馨提示:C装置中装饱和碳酸氢钠溶液,二氧化碳不溶于饱和碳酸氢钠溶液)
①A中的长颈漏斗如果用分液漏斗代替的好处是______
②实验过程B装置产生的主要实验现象是:______;
涉及化学反应是______.
③方线框中的C装置应该选择上面提供的a、b、c、d的______.
查看习题详情和答案>>